Alimentation locale et exposition au mercure en Amazonie brésilienne
 Introduction
Introduction
L’exposition humaine au mercure (Hg) d’origine environnementale constitue un enjeu de santé publique depuis maintenant deux décennies en Amazonie. Les premières études menées à partir de la fin des années 1980 dans les bassins des rivières Madeira et Tapajós au Brésil suggéraient que l’utilisation de Hg dans les mines artisanales d’exploitation aurifère constituait la seule source de contamination environnementale au Hg1. Toutefois, des études géochimiques subséquentes ont montré qu’en plus de l’orpaillage, le retrait de la couverture forestière occasionné par l’agriculture sur brûlis (technique traditionnelle pour cultiver la terre) rendait les sols plus vulnérables à l’érosion lors des pluies torrentielles qui s’abattent sur la région pendant plusieurs mois de l’année2-5. Enfin, à ces sources de contamination au Hg, on reconnaît également aujourd’hui l’apport de la mise en eau de grandes surfaces de terres pour la construction de réservoirs d’eau à des fins hydroélectriques1-3, 5, 6-9.
Une fois rendu dans le milieu aquatique, le Hg subit des transformations chimiques qui le convertissent en méthylmercure (voir encadré 1). Les racines des plantes aquatiques, qui sont très abondantes dans les lacs et les rivières de la région, constituent un lieu propice pour cette transformation. Le méthylmercure ainsi formé entre dans la chaîne trophique pour ensuite être assimilé par les poissons herbivores, puis par les espèces piscivores10-12.
Méthylation du mercure
Dans l’environnement, le mercure se transforme en méthylmercure par l’ajout d’un groupement méthyl (CH3) à des éléments du mercure réactif ou oxydé (Hg2+). La méthylation de Hg2+ est principalement un processus biologique naturel qui entraîne la production de composés de méthylmercure (MeHg+) fortement toxiques, leur bioaccumulation dans les tissus vivants et une augmentation de leur concentration dans la chaîne alimentaire. En raison de sa toxicité très élevée, de sa nature rémanente et de sa bioaccumulation, il est essentiel de comprendre les variables qui influent sur la formation du méthylmercure. On pense qu’une variété de microorganismes, principalement les bactéries qui requièrent du sulfate ainsi que les bactéries méthanogènes participent à la conversion de Hg2+ en MeHg dans certaines conditions anaérobiques que l’on trouve, par exemple, dans des zones humides et des sédiments de rivière, ainsi que dans certains types de sol. La méthylation s’effectue principalement dans des environnements aquatiques à pH faible avec des concentrations élevées de matière organique.
Tiré et adapté d’Environnement Canada13.
De nombreuses études menées dans les pays de l’Amazonie ont fait ressortir des niveaux élevés de mercure chez des populations minières et riveraines. Des effets sur la santé des adultes et des enfants ont été rapportés en lien avec les bioindicateurs de l’exposition au mercure (Hg dans le cheveu et le sang), surtout au niveau des fonctions neurologiques et neurocomportementales, mais également au niveau des systèmes immunitaire et cardiovasculaire (a).
La région du Tapajós (État du Pará, Brésil) était l’une des plus grandes régions productrices d’or dans les années 1970 et 19801, et plus récemment l’une des zones critiques de progression de la frontière agricole au nord du Brésil15-16. Plusieurs équipes de recherche brésiliennes et étrangères mènent depuis un certain temps des études dans cette région. Parmi ces initiatives, les membres du Projet CARUSO(b), initié en 1994, ont entrepris des recherches visant la réduction des niveaux d’exposition au Hg et conséquemment des risques toxicologiques, tout en maintenant une alimentation traditionnelle saine chez les communautés étudiées, par des interventions basées sur la participation communautaire (voir encadré).
Le projet CARUSO: un survol de 15 ans de coopération québéco-brésilienne utilisant une approche écosystémique à la santé humaine
Les recherches participatives menées par l’équipe du projet CARUSO en collaboration avec des communautés riveraines de la vallée de la rivière Tapajós, ont grandement contribué à définir les bases de la problématique de l’exposition environnementale au Hg dans cette région, ainsi qu’à initier des actions permettant de réduire une telle exposition. À partir des travaux de recherche initialement réalisés avec un nombre restreint de communautés, ceux-ci ont été étendus du niveau local au niveau régional à l’échelle du Moyen-Tapajós, pour ainsi définir des interventions adaptées à la diversité des écosystèmes et des communautés17.
Plusieurs résultats significatifs ont découlé du projet. À titre d’exemple, des études biogéochimiques ont montré que la déforestation résultant de l’expansion des pratiques agricoles de coupe et brûlis causait d’importants processus d’érosion des sols riches en Hg naturel, contribuant ainsi à la contamination des cours d’eau de la région et de la faune aquatique2,3,5,8-10. D’autres études ont mis en évidence le fait que les conditions climatiques amazoniennes associées à la présence de végétation aquatique s’avéraient optimales pour la méthylation du Hg, ce qui contribue aussi à l’incorporation du contaminant dans la chaîne alimentaire, atteignant ultimement les villageois qui s’alimentent de poissons7,15.
Le but de cet article est d’illustrer la façon dont cette approche, qui intègre la gestion des ressources alimentaires locales et la biodiversité, peut conduire à une meilleure gestion des risques alimentaires.
Alimentation traditionnelle et exposition environnementale au mercure
Pour les communautés riveraines de la région du Tapajós, les poissons constituent la base du régime alimentaire, résultant en l’ingestion quotidienne de doses élevées de Hg. Il s’avère donc important d’identifier des stratégies viables qui permettent de réduire l’exposition alimentaire tout en maintenant la consommation de poissons, dont les bénéfices sur la santé sont reconnus18. Dans le cadre du projet CARUSO, les études ont montré une association négative entre les résultats des bioindicateurs d’exposition au Hg (cheveux et sang) et la performance aux tests neurocomportementaux, notamment en ce qui concerne la coordination motrice, certaines fonctions visuelles, ainsi que des paramètres cytogénétiques et cardiovasculaires19-23. Compte tenu des niveaux élevés d’exposition au Hg ainsi que des effets observés sur la santé, des projets participatifs ont été mis en place dans le but d’identifier les facteurs qui pourraient atténuer l’exposition à court terme.
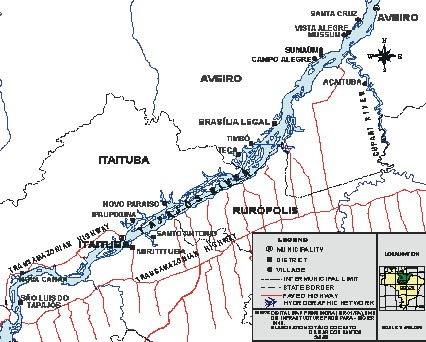
Afin de maximiser les apports nutritionnels des poissons tout en minimisant le risque toxique, une première intervention participative a été réalisée dans le village de Brasília Legal situé sur le bord de la rivière Tapajós (figure 1 ). Cette intervention visait à développer une stratégie de sensibilisation et de renforcement des capacités communautaires, en vue d’encourager la consommation préférentielle d’espèces herbivores moins contaminées15-24. Cette orientation des pratiques de consommation a été réalisée au moyen d’affiches montrant les différents niveaux de Hg entre les très nombreuses espèces de poissons régionaux. Ce type d’approche participative a contribué à réduire les teneurs en Hg corporel d’environ 40 % en 5 ans et ce, sans que la population n’ait eu à diminuer sa consommation totale de poisson. Un suivi de l’état de santé des participants a montré une amélioration des fonctions motrices25 et des indicateurs cytogénétiques26 en lien avec cette baisse de l’exposition.
Figure 1. La carte de la région d’étude – La vallée du Moyen Tapajós, Amazonie brésilienne
Plus de fruits… moins de mercure…
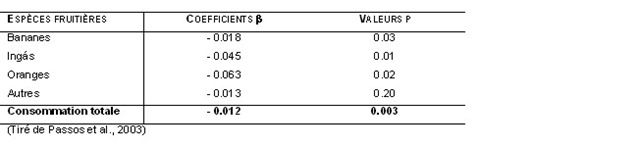
Parallèlement à cette campagne, une enquête alimentaire exploratoire a permis de recenser les aliments faisant partie du régime alimentaire de la population de Brasília Legal, en vue d’identifier des éléments de ce régime pouvant influencer l’absorption de Hg27. Les résultats ont d’abord montré qu’en plus des poissons, qui constituaient la principale source de protéines animales, les villageois consommaient un grand nombre d’aliments provenant tant de la forêt que des jardins familiaux (tableau 1). L’analyse des relations entre la consommation de poissons, les autres aliments et les bioindicateurs d’exposition au Hg a permis de mettre en évidence l’influence de la consommation de fruits régionaux sur la relation entre la consommation de poissons et les teneurs en Hg dans les cheveux (tableau 2). Ainsi, pour une même consommation de poissons, les personnes qui consommaient des fruits plus fréquemment présentaient des teneurs en Hg inférieures à celles qui en consommaient moins souvent28. Par la suite, plusieurs études épidémiologiques régionales ont permis de confirmer l’influence des fruits sur cette relation29-32. Cet effet modulateur des fruits pourrait s’expliquer par leur contenu en fibres alimentaires ainsi que par la présence d’autres nutriments pré-biotiques, qui interféreraient avec le processus d’absorption du Hg au niveau du tractus gastro-intestinal37-41. Des études expérimentales sont actuellement en cours pour vérifier ces hypothèses.
Tableau 1. Les catégories alimentaires et leurs caractéristiques nutritionnelles
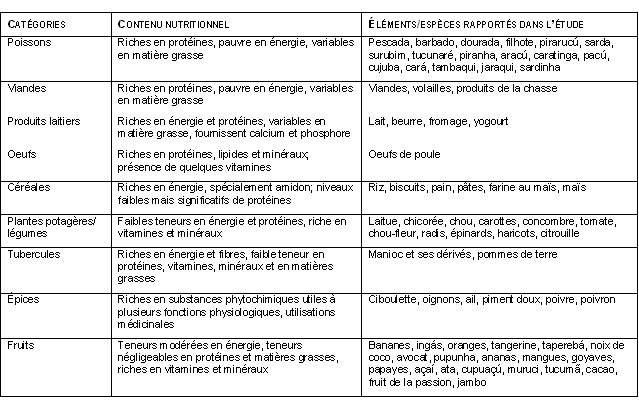
Tableau 2. Coefficients de régression (b1) pour la fréquence de consommation de fruits (repas/année) dans des modèles multiples avec la consommation de poissons (repas/année) comme variable indépendante et les teneurs en Hg dans les cheveux (µg/g)
Limites et futurs défis
Les études précédemment résumées suggèrent que les effets modulateurs de la consommation de fruits régionaux constituent une avenue prometteuse qui mérite d’être explorée davantage en tant que stratégie potentielle d’intervention à court terme pour diminuer les niveaux d’exposition alimentaire au Hg en Amazonie.
Ce type de constat illustre bien les avantages d’une démarche écosystémique qui cible les problèmes de santé reliés à la perturbation de l’environnement, réunit des chercheurs de disciplines variées et s’appuie sur la participation communautaire. L’échange de réflexions entre chercheurs, ainsi que le partage de données récoltées dans une même zone d’étude, ont été d’une importance capitale dans l’atteinte des objectifs. À titre d’exemple, les données de contamination de chaque espèce de poisson recueillies par les biogéochimistes ont été mises en relation avec les données des questionnaires alimentaires épidémiologiques. Cette collaboration a permis de calculer l’apport quotidien en Hg de façon relativement précise et d’analyser le rôle des fruits à l’égard de ce type d’apport toxique.
De la même manière, nos collègues spécialisés en sciences humaines nous ont permis de mieux comprendre la dynamique sociale au sein des communautés impliquées. Leurs analyses ont notamment révélé l’importante responsabilité des femmes dans la sélection des aliments, la préparation de la nourriture et sa distribution aux membres du foyer familial, faisant de celles-ci des personnes cibles lors des interventions alimentaires chez les populations traditionnelles amazoniennes.
De plus, les résultats obtenus font ressortir la nécessité d’accorder une plus grande attention et de mettre davantage en valeur la biodiversité des ressources naturelles animales et végétales retrouvées dans l’immense mosaïque d’écosystèmes qu’est l’Amazonie. La grande diversité et l’accessibilité à des espèces d’arbres fruitiers et de poissons, illustrent bien l’importance stratégique de l’utilisation d’une telle biodiversité des ressources naturelles amazoniennes sur l’atténuation à court terme de la charge de Hg chez ces populations.
Ces résultats, bien qu’encourageants, ne suffisent toutefois pas à apporter des solutions durables et à long terme au problème de contamination environnementale et humaine. Il existe d’abord un besoin urgent de favoriser l’interaction entre les autorités sanitaires régionales et nationales et les équipes de recherche. Cette collaboration permettra d’utiliser davantage les connaissances scientifiques générées au cours de ces vingt années de recherche en Amazonie, et de stimuler la mise en œuvre de politiques publiques visant à diminuer les niveaux d’exposition humaine dans l’ensemble de la population amazonienne. Il serait souhaitable que les efforts d’intervention alimentaire soient couplés à des interventions à moyen et à long terme visant à réduire la lixiviation du Hg des sols vers les écosystèmes aquatiques grâce à de meilleures pratiques agricoles et à une gestion plus durable du territoire, tels que proposés par Farella et al.10,42. Enfin, ces études renforcent aussi l’importance de considérer l’influence des facteurs alimentaires et nutritionnels lors de l’évaluation des risques et des effets toxiques d’origine environnementale32.
Quant à la poursuite des recherches, plusieurs questions demeurent et des pistes restent à explorer. Par exemple, bien que ces études montrent une influence de la consommation de fruits sur le niveau de Hg sanguin, et malgré que quelques études récentes aient montré qu’un nombre très restreint de fruits amazoniens présentent des contenus élevés en plusieurs substances antioxydantes43-47, le(s) mécanisme(s) d’action ainsi que les nutriments impliqués dans ces réactions restent toujours à élucider. Le fait que la composition nutritionnelle et phytochimique de la plupart des fruits consommés dans la région du Tapajós demeure inconnue confirme cette lacune. Pour y parvenir, il faudra notamment connaître la composition nutritionnelle et phytochimique de l’ensemble des fruits consommés dans la région du Tapajós. Les métabolites végétaux secondaires présents dans ces fruits ont un grand potentiel en termes de propriétés bioactives, et sont à la base des principales hypothèses émises en vue d’expliquer les possibles mécanismes d’action modulatrice des fruits sur la bioaccumulation du Hg chez l’humain.
Références
- Malm, O., 1998. Gold mining as a source of mercury exposure in the Brazilian Amazon. Environ Res Section A 77: 73-78.
- Roulet M, Lucotte M, Saint-Aubin A, Tran S, Rhéault I, Farella N, De Jesus da Silva E; Dezencourt J, Passos CJS, Santos Soares G, Guimarães JRJ, Mergler D. and Amorim M., 1998. The geochemistry of Hg in Central Amazonian soils developed on the Alter-do-Chão formation of the lower Tapajós river valley, Pará state, Brazil. Sci Total Environ 223: 1-24.
- Roulet M, Lucotte M, Farella N, Serique G, Coelho H, Passos CJS, de Jesus da Silva E, de Andrade PS, Mergler D, Guimaraes JRD, Amorim M., 1999. Effects of recent human colonization on the presence of mercury in Amazonian ecosystems. Water Air Soil Poll. 112: 297-313.
- Roulet, M., Lucotte, M., Canuel, R., Farella, N., Courcelles, M., Guimarães, JRD., Mergler, D., Amorim, M., 2000. Increase in mercury contamination recorded in lacustrine sediments following deforestation in the central Amazon. Chem Geol 165: 243-266.
- Farella N, Lucotte M, Louchouarn P and Roulet M., 2001. Deforestation modifying terrestrial organic transport in the Rio Tapajós, Brazilian Amazon. Org Geochem 32: 1443-1458.
- Farella, N., Lucotte, M., Davidson, R., Daigle, S., 2006. Mercury release from deforested soils triggered by base cation enrichment. Sci Total Environ 368: 19-29.
- Bastos, WR., et al., 2006. Mercury in the environment and riverside population in the Madeira River Basin, Amazon, Brazil. Sci Total Environ 368: 344-351.
- Gammons CH, Slotton DG, Gerbrandt B, Weight W, Young CA, McNearny RL, Cámac E, Calderón R, Tapia H. Mercury concentrations of fish, river water, and sediment in the Río Ramis-Lake Titicaca watershed, Peru. Sci Total Environ 2006, 368:637-648.
- Hylander LD, Grohn J, Tropp M, Vikstrom A, Wolpher H, Silva EC, Meili M, Oliveira LJ. Fish mercury increase in Lago Manso, a new hydroelectric reservoir in tropical Brazil. J Environ Manag 2006, 81:155-166.
- Guimarães, JRD., Fostier, AH., Forti, MC., et al., 1999. Mercury in human and environmental samples from two lakes in Amapá, Brazilian Amazon. Ambio 28(4): 296-301.
- Guimarães, JRD., 2001. Les processus de méthylation du mercure en milieu amazonien. In: Carmouze JP, Lucotte M and Boudou A (coord.), Le mercure en Amazonie: Rôle de l’homme et de l’environnement, risques sanitaires. IRD Éditions, Paris.
- Da Silva, DS., Lucotte, M., Roulet, M., Poirier, H., Mergler, D., Crossa, M., 2006. Mercury in fish of the Tapajós River in the Brazilian Amazon. INTERFACEHS 1(1), art 6.
- Environnement Canada, site web http://www.ec.gc.ca/MERCURY/EH/FR/eh-b.cfm. Page consultée le 18 décembre 2008.
- Passos, CJS., Mergler, D., 2008. Human mercury exposure and adverse health effects in the Amazon: a review. Cad. Saúde Pública, Rio de Janeiro, 24 sup 4, S503-S520.
- Lucotte M, Davidson R, Mergler D, Saint-Charles J, Guimarães JR (2004) Human exposure to mercury as a consequence of landscape management and socio-economical behaviors. Part I: the Brazilian Amazon case study. RMZ-M&G, 51: 668-672.
- Wood, CH., Porro, R., 2002. Deforestation and land use in the Amazon. Gainesville: University Press of Florida.
- Lebel, J., 2003. La santé: une approche écosystémique. Centre de recherches pour le développement international, Ottawa, 84 p.
- Lecerf, JM., 2004. Poisson, acides gras omega-3 et risque cardiovasculaire: données épidémiologiques. Cahiers de nutrition et diététique 39(2): 143-150.
- Lebel, J., Mergler, D., Lucotte, M., Amorim, M., Dolbec, J., Miranda, D., Arantes, G., Rheaulth, I., Pichet, P., 1996. Evidence of early nervous system dysfunctions in Amazonian populations exposed to low-level of methyl mercury. Neurotoxicology 17(1): 157-168.
- Lebel, J., Mergler, D., Branches, F., Lucotte, M., Amorim, M., Larribe, F., Dolbec, J., 1998. Neurotoxic effects of low-level methyl mercury contamination in the Amazonian Basin. Environ Res 79: 20-32.
- Dolbec, J., Mergler, D., Passos, C.J.S., Morais, S.S., Lebel, J., 2000. Methyl mercury exposure affects motor performance of a riverine population of the Tapajós River, Brazilian Amazon. Int Arch Occup Environ Health 73: 195-203.
- Amorim, M.I.M., Mergler, D., Bahia, M.O., Dubeau, H., Miranda, D., Lebel, J., Burbano, R.R., Lucotte, M., 2000. Cytogenetic damage related to low levels of methyl mercury contamination in the Brazilian Amazon. An. Acad. Bras. Ci. 72(4): 497-507.
- Fillion, M., Mergler, D., Passos, CJS., Larribe, F., Lemire, M., Guimarães, JRD., 2006. A preliminary study of mercury exposure and blood pressure in the Brazilian Amazon. Environ Health, 5:29
- Mertens, F., Saint-Charles, J., Mergler, D., Passos, CJ., Lucotte, M., 2005. A network approach for analysing and promoting equity in participatory ecohealth research, 2: 113-126.
- Mergler, D., Boischio, AA., Branches, F., Morais, S., Passos, CJ., Gaspar, E., Lucotte, M., 2001. Neurotoxic sequelae of methyl mercury exposure in the Brazilian Amazon: a follow-up study. In: Proccedings of the 6th International Conference on Mercury as a Global Pollutant. October 2001, Minamata, Japan, 15 – 19.
- Bahia, MO., Corvelo, TC., Mergler, D., Burbano, RR., Lima, PDL., Cardoso, CS., Lucotte, M., Amorim, MIM., 2004. Environmental biomonitoring using cytogenetic endpoints in a population exposed to mercury in the Brazilian Amazon. Environ Mol Mutagen 44: 346-349.
- Passos, CJ., et al., 2001. Characterization of the diet of a riverside population in the Brazilian Amazon. Rev Saúde & Ambiente 4(1/2): 72-84.
- Passos, C.J., et al., 2003. Eating tropical fruit reduces mercury exposure from fish consumption in the Brazilian Amazon. Environ Res 93: 123-130.
- Passos, CJS., Mergler, D., Fillion, M., Lemire, M., Mertens, F., Guimarães, JRD., 2005. Further Evidence of the Effects of Fruit Consumption in Lowering Mercury Exposure. Annales du XIII International Conference on Heavy Metals in the Environment, 05 au 9 juin 2005, Rio de Janeiro - Brésil.
- Passos, CJS., Mergler, D., Fillion, M., Lemire, M., Mertens, F., Guimarães, JRD., Phillibert, A. 2007a. Epidemiologic confirmation that fruit consumption influences mercury exposure in the Brazilian Amazon. Environ Res. 105: 183-193.
- Passos, CJS., Mergler, D., Lemire, M., Fillion, M., Guimarães, JRD., 2007b. Fish consumption and bioindicators of inorganic mercury exposure. Sci Total Environ 373: 68-76.
- Passos, CJS., da Silva, DS., Lemire, M., Fillion, M., Guimarães, JRD., Lucotte, M., Mergler, D., 2008. Daily mercury intake in fish-eating populations in the Brazilian Amazon. Journal of Exposure Science and Environmental Epidemiology 18: 76-87.
- Rowland, I.R., Mallett, A.K., Flynn, J., Hargreaves, R.J., 1986. The effect of various dietary fibers on tissue concentration and chemical form of mercury after methylmercury exposure in mice. Arch Toxicol 59: 94-98.
- Rowland, IR., 1988. Factors affecting metabolic activity of the intestinal microflora. Drug Metab Rev. 19 (3-4): 243-261.
- Peraza, M.A., Ayala-Fierro, F., Barber, D.S., Casares, E., Rael, L.T., 1998. Effects of micronutrients on metal toxicity. Environ Health Perspect 106, Suppl 1: 203-216.
- Bravo, L., 1998. Polyphenols: Chemistry, dietary sources, metabolism, and nutritional significance. Nutr Rev 56(11): 317-333.
- Chapman, L., Chan, H. M., 2000. The influence of nutrition on methyl mercury Intoxication. Environ Health Perspect. 108(suppl 1): 29-56.
- Clarkson, TW., 2002. The three modern faces of mercury. Environ Health Perspect 110 (suppl 1): 11-23.
- Clarkson, TW., Strain, JJ., 2003. Nutritional factors may modify the toxic action of methyl mercury in fish-eating populations. J Nutr. 133: 1539S-1543S.
- Gibson, GR., Probert, HM., Loo, JV., Rastall, RA., Roberfroid MB., 2004. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev 17: 259-275.
- Roberfroid, MB., 2005. Introducing inulin-type fructans. Brit J Nutr 93(suppl 1): S13-S25.
- Farella, N., Davidson, R., Lucotte, M., Daigle, S., 2007. Nutrient and mercury variations in soils from family farms of the Tapajós region (Brazilian Amazon): recommendations for better farming. Agrictulture, Ecosystems and Environment 120: 449-462.
- Del Pozo-Insfran, D., Percival, SS., Talcott, ST. 2006. Açai (Euterpe oleracea Mart.) polyphenolics in their glycoside and aglycone forms induce apoptosis of HL-60 leukemia cells. J. Agric. Food Chem. 54: 1222-1229.
- Del Pozo-Insfran, D., Brenes, CH., Talcott, ST. 2004. Phytochemical composition and pigment stability of Açai (Euterpe oleracea Mart.). Journal of Agricultural and Food Chemistry 52: 1539-1545.
- Lichtenthaler, R., Rodrigues, RB., Maia, GS., et al. 2005. Total oxidant scavenging capacities of Euterpe oleracea Mart. (Açai) fruits. International Journal of Food Sciences and Nutrition 56(1) : 53-64.
- Arabbi, PR., Genovese, MI., Lajolo, FM. 2004. Flavonoids in vegetable foods commonly consumed in Brazil and estimated ingestion by the Brazilian population. J. Agric. Food Chem 52: 1124-1131.
- Andrade, EH., Zoghbi, MGB., Maia, JGS., Fabricius, H., Marx, F. 2001. Chemical characterization of the fruit of Annona squamosa L. occurring in the Amazon. Journal of Food Composition and Analysis 14: 227-232.
(a) Pour une revue de la littérature scientifique voir Passos et Mergler 200814
(b)www.unites.uqam.ca/gmf/caruso/caruso.htm
Remerciements : L’auteur tient à remercier sincèrement toutes les personnes des villages riverains de la région du Tapajós qui ont activement participé aux études sur la consommation de poissons et de fruits en rapport avec l’exposition au mercure. Merci également à Myriam Fillion, Mélanie Lemire, Frédéric Mertens, Delaine Sampaio et Donna Mergler pour leur collaboration et apports indispensables à la réalisation de ces travaux.

