Penicillium spp.
Introduction
Il y a plus de 200 espèces reconnues de Penicillium. Plusieurs espèces s'adaptent facilement aux conditions de croissance présentes à l'intérieur et se développent bien sur des matériaux de construction humides. Plus de vingt espèces sont régulièrement trouvées dans l'environnement intérieur {2694, 1056, 470}. Par conséquent, il serait impossible de les énumérer toutes dans le contexte de ce compendium. La majorité de cette rubrique sera donc consacrée au genrePenicillium dans son ensemble, et certaines espèces seront mentionnées au besoin.
Taxonomie
| Règne | Fungi | Famille | Trichomaceae |
| Phylum | Ascomycota | Genre | Penicillium |
| Classe | Euascomycetes | Espèce | spp. |
| Ordre | Eurotiales |
Plusieurs Penicillium sont des formes imparfaites (anamorphes) d'hyphomycètes hyalins : quelques espèces de Penicilliumpossèdent des formes parfaites (télémorphes) incluses dans les genres Eupenicillium, Talaromyces, Hamigera etTrichocoma {3133}.
Écologie
Les Penicillium sont très généralement retrouvés dans le sol, sur les végétaux en décomposition et le compost de même que sur le bois, les produits alimentaires secs, les épices, les céréales, les fruits frais et les légumes {808, 3095}; on les trouve également poussant sur des matériaux de construction dans des environnements endommagés par l’eau {413} ainsi que dans l’air intérieur et la poussière domestique.
Plus de détails
Les Penicillium sont l'un des agents les plus communs de la détérioration des fruits et des légumes. Par exemple, leP. italicum et le P. digitatum sont des agents communs de la pourriture des agrumes, alors que le P. expansum est reconnu pour faire pourrir les pommes {798, 3090}.
Le genre Penicillium fait partie des cinq genres les plus communs dans les aérosols fongiques extérieurs {3003, 2649, 2747, 2759}. Il est présent presque toute l’année dans l’air extérieur : ses concentrations subissent des variations saisonnières et il constitue une petite proportion de la flore fongique normale aérosolisée dans les zones climatiques nordiques. Les Penicillium sont présents en plus grandes concentrations pendant l'automne et l'hiver, bien qu'il soient présents toute l'année {3012, 624, 2014}.
Exigences de croissance
Les Penicillium sont des mycètes mésophiles pouvant croître entre 5 et 37 °C (température optimale de 20-30 °C) à un pH de 3-4,5. La croissance est optimale in vitro à 23 °C, à un pH de 3-4,5.
Activité de l'eau : Aw = 0,78-0,88 {808}
Croissance sur matériaux de construction et en environnement intérieur
Les Penicillium ont été mesurés en concentrations significatives dans 53 % des maisons contaminées par des moisissures avant des travaux {1582}. Des espèces de Penicillium peuvent coloniser les matériaux absorbants tels que les panneaux de gypse {3055}, le matériel isolant {3004, 3014}, les doublures de fibre de verre des systèmes CVC {3005} ainsi que les tapis et les moquettes {1072}.
Plus de détails
Une étude scandinave a démontré que les produits les plus vulnérables à la contamination par les moisissures étaient les matériaux organiques contenant de la cellulose et endommagés par l'eau, notamment le jute, le papier peint et le carton. Dans cette étude, le genre le plus souvent décelé sur ces substrats était le Penicillium (prévalence de 68 %) {605}.
D’autres études ont démontré que certaines espèces de Penicillium peuvent se développer sur des matériaux de construction tels que le papier peint, les panneaux de gypse et les panneaux de plafond à base de cellulose, en particulier après des dégâts d’eau ou des inondations {3044, 315, 695}. En outre, l'isolant de cellulose appliqué par pulvérisation humide (wet spray-applied cellulose insulation en anglais ou WSACI) favorise un niveau élevé de contamination par les Penicillium {670}. La croissance du P. chrysogenum sur ce type de matériaux, dans des bâtiments endommagés par l’eau, peut atteindre une concentration très élevée : dans un édifice, le décompte atteignait deux millions de spores par gramme d'échantillon brut {670}.
En plus de l’isolant humide et de la cellulose, les tapis sont également facilement contaminés par les moisissures, principalement par les espèces de Penicillium {1072}.
Lors d'une étude expérimentale ayant trait à la croissance des moisissures, les Penicillium ont été visuellement détectés deux semaines après l'ensemencement sur des panneaux de gypse non traités {587}. Des souches de Penicillium, deCladosporium et d'Acremonium étaient les colonisatrices primaires des panneaux non traités. De plus, ces mycètes sont souvent trouvés dans les cavités murales et peuvent conséquemment être difficiles à déceler en milieu intérieur {2069}.
En particulier, le Penicillium chrysogenum est un important contaminant du milieu intérieur; il est considéré comme un des colonisateurs primaires des murs et des cloisons dans les bâtiments endommagés par l’eau {911}. Cette moisissure est la plus fréquemment rencontrée en milieu intérieur {951}. Elle se trouve souvent dans les bâtiments moisis où elle détruit divers matériaux de construction et de revêtement tel le papier peint. Elle se développe également bien sur la colle du papier peint et des panneaux d’aggloméré (panneaux de particules) humides et dans les finis peints {725}.
Le Penicillium est rapporté, en même temps que l’Aspergillus, le Cladosporium, le Paecilomyces, ou bien en combinaison avec les trois à la fois, comme étant le principal contaminant intérieur après des dégats d'eau occasionnés par une inondation {620} ou suivant un incendie {3067, 2841}, ou dans des bâtiments aux prises avec des problèmes chroniques d'humidité {575}. Des espèces de Penicillium sont également constamment présentes dans les prélèvements d'air et de surfaces des installations de piscines {1578}.
Il faut rappeler que les concentrations totales d’éléments fongiques aéroportés en milieu intérieur dépendent aussi bien des sources et des taux d'humidité dans le bâtiment que du type de revêtement, des niveaux d'aération et de la fréquence de nettoyage du bâtiment et, à un moindre degré, de la présence d’animaux de compagnie {2747, 624}. Il ne faut pas oublier que les fluctuations saisonnières et les types d'environnements extérieurs contribuent en grande partie à la variabilité du niveau de base de la flore fongique en milieu intérieur {3021}.
Laboratoire
La manipulation des cultures de ce genre doit se faire en respectant
les précautions de laboratoire de base (niveau de biosécurité 2).
Morphologie macroscopique des colonies
La taxonomie du genre Penicillium est particulièrement complexe et difficile à maîtriser. L’identification précise basée seulement sur les critères macromorphologiques et micromorphologiques demeure difficile, bien qu'elle soit possible. Cependant, quelques traits communs sont partagés par les espèces les plus répandues en milieu intérieur {1056}. Les colonies de ces espèces sont habituellement à croissance rapide; elles peuvent être de différentes teintes de vert ou occasionnellement de teintes de blanc ou d'autres couleurs. Elles se composent la plupart du temps d'une masse feutrée de conidiophores. La surface de la colonie présente souvent quelques exsudats et le revers peut être de blanc à jaunâtre.
Plus de détails
Les colonies se développent rapidement sur des milieux de culture standards. Elles sont plates et leur texture varie de veloutée à ouatée. Elles peuvent même présenter des cordons mycéliens et jeunes; elles sont blanches ou vert pâle; à maturité, les différentes espèces présentent un éventail de couleurs, mais le plus souvent avec une certaine nuance de vert. Elles peuvent être de bleues à vertes, grises, jaunes, olive ou même rosâtres. Plusieurs espèces produisent des gouttelettes d'exsudat coloré ou incolore.
Les colonies de P. chrysogenum se développent rapidement et atteignent, à 25 °C sur gélose de Czapek, un diamètre de 4-5 cm en dedans de dix jours. Les colonies sont plates et de texture veloutée à ouatée; elles sont blanches ou vert-jaune pâle, puis bleues et vertes, olive grisâtre (vert-de-gris), jaunes ou même rosâtres. Avec le temps, une large frange soulevée blanche de mycélium peut apparaître au pourtour de la colonie, et, en surface, il peut y avoir de nombreuses gouttelettes d’exsudat souvent jaunes ou parfois diaphanes. L'odeur qui s’en dégage est habituellement aromatique, fruitée. Le revers de la colonie est le plus souvent de blanc à jaunâtre ou blanc-jaune {877, 816, 814, 724}.
Morphologie microscopique
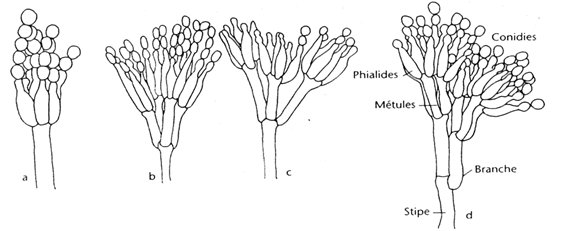
Les hyphes hyalins septés (1,5-5 µm de diamètre) portent des conidiophores ramifiés ou non ramifiés. La première cellule du conidiophore est appelée cellule pied; les branches secondaires sont connues sous le nom de métules. Les métules sont plus ou moins cylindriques, à parois lisses, portant de trois à six phialides en forme de bouteille {816, 412, 724}. Les phialides produisent de longues chaînes sèches de petites spores rondes à ovales (2,5-5 µm). Les souches peuvent être classées en quatre catégories selon le type de ramification des conidiophores.
Plus de détails
Quand la cellule pied se termine directement en un conidiophore en forme de pinceau (penicillus) de phialides, c'est-à-dire sans cellules intermédiaires ramifiées, la souche est dite monoverticillée. Si le penicillus est embranché, il peut être ramifié à un étage (biverticillé), à deux étages (triverticillé) ou à trois étages (quaterverticillé).
Les conidies sont la plupart du temps presque sphériques ou ellipsoïdes, rarement cylindriques ou fusiformes; les conidies sont petites, de 2,5-4 µm, hyalines ou légèrement verdâtres, à paroi lisse, habituellement produites en chaînes divergentes ou en colonnes lâches {725, 816, 814, 724}.
Les spores solitaires de Penicillium ne peuvent pas être différenciées des spores d'Aspergillus ou des autres genres possédant de petites spores rondes et ovales, incolores ou légèrement pigmentées. Ainsi, à l'examen direct des échantillons d'air, ces spores sont rapportées comme étant des spores de « Asp/Pen ».
Les chaînes de conidies unicellulaires (ameroconidies) sont produites en succession basipétale, à partir d'une cellule conidiogène spécialisée appelée phialide. Le terme de conidiogenèse acropète (basocatenate) est souvent employé pour décrire de telles chaînes de conidies, où la plus jeune conidie est à la base de la chaîne, c'est-à-dire qu'elle est la cellule proximale de la chaîne.
Chez les Penicillium, les phialides sont produites soit séparément, soit en groupes, soit à partir des métules ramifiées et donnent un ensemble ressemblant à un pinceau, connu sous le nom de penicillus ou pénicille. Le penicillus peut donc contenir des branches et des métules (les branches pénultièmes qui soutiennent une spirale des phialides). Toutes les cellules situées entre les métules et les pieds des conidiophores sont désignées sous le nom de branches.
Les conidiophores sont hyalins et peuvent être à paroi lisse ou rugueuse. Les phialides sont souvent en forme de bouteille et se composent soit d'une cellule à base cylindrique avec un cou distinct, soit d'une cellule lancéolée, c'est-à-dire à base étroite effilée se terminant en un apex légèrement pointu. Les conidies sont sphériques, ellipsoïdes, cylindriques ou fusiformes, hyalines ou verdâtres, lisses ou rugueuses. Quelques espèces produisent des sclérotes {1056}.
Métabolites spécifiques
Le Penicillium est surtout connu comme étant le producteur du premier antibiotique, la pénicilline. De fait, les espèces dePenicillium peuvent produire plusieurs composés organiques et un grand nombre de métabolites spécifiques, y compris certains métabolites possédant des propriétés antibiotiques et antivirales de même que des mycotoxines puissantes.
Plus de détails
Le P. chrysogenum, une espèce commune de Penicillium autrefois appelée le P. notatum, est la source bien connue de la pénicilline. En 1928, des cultures bactériennes du chercheur Alexandre Fleming ont été souillées par les spores aéroportées d'une moisissure verte. Sir Fleming a noté que les bactéries ne se développaient pas près de la moisissure verte. Il a conclu que la moisissure produisait un composé qui tuait ou empêchait la croissance des bactéries. Voici comment la pénicilline, le plus ancien et le plus connu de tous les antibiotiques, a été accidentellement découverte.
Composés organiques (incluant les COV)
Les espèces de Penicillium produisent divers hydrocarbures, des alcools, des cétones, des esters et des terpènes, aussi bien dans la nature que sur des matériaux de construction {594, 2076}. Les métabolites les plus courants comprennent certains alcools tels que le 2-méthyl-1-propanol, le 3-méthyl-1-butanol et le 1-hexanol de même que le 2-heptanone, le 2-pentanone et le 2,5-diméthyl-furane {607}; quelques Penicillium produisent du 2-méthyl-isobornéol qui donne une forte odeur de moisi. La production de composés organiques volatils microbiens (MCOV) dépend à la fois de l’espèce en cause et du milieu où pousse la moisissure.
Un certain nombre de composés organiques, y compris les composés organiques volatils (COV), ont été identifiés dans l'air intérieur de bâtiments humides. Ces métabolites contribueraient à différents problèmes de santé associés à la qualité de l’air intérieur. La plupart des métabolites identifiés sont toutefois non réactifs et sont trouvés en faibles concentrations dans l'air intérieur {594}.
Plus de détails
Certaines espèces de Penicillium ont un profil spécifique de MCOV, mais ce profil peut être modifié considérablement en réponse à des facteurs externes tels que la composition des différents substrats permettant leur croissance. De fait, la culture sur différents substrats modifie à la fois le nombre et la concentration des MCOV {2968, 1148, 2809}. Certains composés peuvent être produits par différentes moisissures, tandis que quelques composés volatils sont propres à une seule espèce {2809}.
Le P. chrysogenum est connu comme producteur de dizaines d'acides organiques, d'acides aminés et d'enzymes. LeP. chrysogenum produit certains composés organiques volatils (COV), principalement des composés C2-C4, des isopropènes, des alcools, des terpènes, des octadiènes et des cétones méthyliques : au moins 30 composés spécifiques ont été identifiés {947}. Le P. chrysogenum peut produire plusieurs COV lorsqu'il est cultivé expérimentalement sur des matériaux de construction tels que des panneaux de gypse (placoplâtre) et des nouveaux matériaux cartonnés {947}. Cependant, la production de métabolites secondaires est plus faible sur les matériaux de construction que sur les milieux de culture gélosés synthétiques complets {603}.
Le Penicillium commune produit sur des panneaux de bois de pin et des panneaux de gypse des métabolites tels que le 3-méthyl-1-butanol, le 2-méthyl-1-butanol, le 2-méthyl-1-propanol, le 2-butanone et le 1-méthoxy-3-méthylbutane. Une étude a démontré que sur le bois de pin contaminé par le P. commune, les alcools sont les composés dominants, tandis que la géosmine est produite lors de la contamination des panneaux de gypse et de la laine minérale. Conséquemment, ces derniers panneaux, une fois contaminés, ont une forte odeur terreuse.
Une étude menée sur le Penicillium commune et le Paecilomyces variotii démontre que plusieurs composés sont produits quand ces moisissures sont cultivées sur du pin et des panneaux composites {607}. Sur des panneaux de gypse et de la laine minérale, les deux espèces produisent du 2-méthyl-l-propanol. Les composés de type sesquiterpénoïde étaient les produits principaux des deux espèces sur ce milieu. Par contre, sur le pin, aucun composé de type terpénoïde produit par les mycètes n'a pu être détecté.
Le cyclopénol, la cyclopénine et le pénitrem A (mycotoxine) sont propres à certains Penicillium et ont été trouvés dans les extraits de spores; ils seraient probablement produits dans les bioaérosols naturels {1148}.
Des propagules aérosolisées de Penicillium étaient associées au syndrome des édifices malsains (SBS) {2649}. Pourtant, même lorsqu'une croissance fongique dense a été observée en surface à l’intérieur des systèmes CVC, la plupart des échantillons d'air des pièces desservies sont à des concentrations de moins de 200 ufc/m³ {3005}. Il a été observé que la contamination des gaines isolantes peut mener secondairement à la contamination des unités de traitement de l’air {527}; cette croissance libère ensuite des métabolites fongiques tels que l'acétone et un composé de type sulfure de carbonyle {3004}.
Mycotoxines
Plusieurs espèces de Penicillium sont des contaminants communs sur divers matériaux organiques et sont des productrices potentielles reconnues de mycotoxines. Parmi les mycotoxines les mieux étudiées produites par lesPenicillium, il faut mentionner les composés suivants : l'acide kojique, l'acide mycophénolique, l'acide pénicillique, l'aflatoxine, la citréoviridine, la citrinine, la citromycétine, l'érythroskyrine, la fréquentine, la gibbérelline, la griséofulvine, l'hadacidine, la luteoskyrine, des mycotoxines trémorgènes (le pénitrem, le territrem, le verruculogène), les ochratoxines A et B, l'oxaline, la paruline, la patuline, les pénitrems A à F, la riboflavine, la roquefortine, la rubratoxine, la rugulosine, la rugulovasine, les thomitrems A et E, la verrucosidine, la viomelleine, la viridicatine, la xanthocilline et la xanthomegnine {989, 3102, 927, 3176}.
La plupart de ces toxines sont associées à la détérioration de la nourriture et du grain. Quelques-unes ont été étudiées dans des cas de contamination du milieu intérieur. Peu d’études se sont intéressées spécifiquement aux toxines des Penicilliumen milieu intérieur, mais certains chercheurs ont démontré la présence de toxines en milieu intérieur contaminé entre autres par le Penicillium {620, 1203, 2991, 550, 795, 1066}. La connaissance des mycotoxines produites par les Penicillium, toutes origines confondues, permet de réaliser l’ampleur des risques pour la santé associés à ces toxines, y compris les risques potentiels en milieu intérieur.
Plus de détails
Les espèces les mieux connues de moisissures toxinogènes associées à la nourriture comprennent le P. citreonigrum,le P. citrinum, le P. crustosum, le P. islandicum et le P. verrucosum. Étant donné le nombre d’espèces toxinogènes et la variété de toxines pouvant être produites, il est donc souvent important d’identifier correctement les Penicillium à l’espèce lorsqu’il s’agit d’études portant sur les contaminants de la nourriture.
Le P. chrysogenum synthétise des mycotoxines de la famille des alcaloïdes et certaines mycotoxines du groupe des stérols comme le fungisterol {989, 997, 607, 2826}. De plus, il produit des toxines comme la roquefortine C sur d'autres substrats que la nourriture. Initialement, la roquefortine C a été isolée à partir de cultures de Penicillium roquefortii qui est industriellement employé pour la production des fromages bleus. Toutefois, dans les conditions normales de production des fromages, cette toxine n'est pas élaborée {950}, mais elle peut se trouver sur d'autres substrats.
L’ochratoxine A (OTA), une mycotoxine puissante produite par des espèces de Penicillium et d'Aspergillus, contamine plusieurs produits agroalimentaires et représente un risque sanitaire important (3008). De plus, des matériaux de construction fortement colonisés par le Penicillium et d'autres mycètes contiennent cette mycotoxine, et les poussières aéroportées de conidies pourraient être des sources d'OTA {606, 1220}. Les expositions maximales à de l'OTA aéroportée peuvent être significatives, par exemple, dans des environnements d'industries agroalimentaires {1220, 1550}.
La plupart des souches de P. citrinin produisent de l’acide pénicillinique et de la citrinine lorsqu’elles poussent sur des hydrates de carbone tels que l'amidon {3034}.
Les souches de Penicillium expansum sont les principales productrices de la patuline dans la nature : cette mycotoxine est produite sur des fruits avariés. La contamination par la patuline engendre une préoccupation importante en ce qui concerne la santé humaine parce que l'exposition à cette toxine peut avoir comme conséquence des effets toxiques aigus et chroniques graves, y compris des effets cancérogènes, mutagènes et tératogènes. L'Organisation des Nations unies pour l'alimentation et l'agriculture (FAO) a fixé un apport quotidien tolérable de 0,4 ug/kg de poids corporel. Il est important de noter que lors de la conservation des cidres et des jus de pomme, les concentrations de patuline peuvent atteindre de 538 à 1 822 ug/ml et, même lorsque ces aliments sont conservés au froid à 4 °C, on peut retrouver de 75 à 396 ug/ml de patuline dans ces derniers : ces concentrations sont potentiellement toxiques {3197, 3198}. Une étude expérimentale a permis de montrer la présence de patuline et de citrinine dans des extraits de pommes stockées à 25 °C douze jours après inoculation de Penicillium expansum {3090}.
Quelques souches de Penicillium chrysogenum, isolées à partir d’échantillons d’air intérieur, produisent, à certaines températures, une hémolysine protéineuse, la chrysolysine (chrysolysinTM). Les études sur des lignées cellulaires suggèrent que la chrysolysine pourrait agir en favorisant la réponse inflammatoire, chez le sujet exposé auP. chrysogenum, en déclenchant la production d’une protéine proinflammatoire dirigée contre les macrophages (MIP‑2) {1534}.
Problèmes de santé
Les risques sanitaires associés à l'exposition aux moisissures dans les bâtiments endommagés par l’eau sont bien établis; ceci est particulièrement vrai en ce qui a trait aux maladies des voies respiratoires supérieures et inférieures. LesPenicillium étant parmi les moisissures les plus répandues en milieu intérieur, ils peuvent contribuer de manière significative aux différents problèmes de santé associés à la qualité de l’air intérieur.
Irritation et inflammation
D’une manière générale, toutes les moisissures contiennent des substances irritantes qui peuvent produire de l'inflammation à différents degrés. On considère que certains composés organiques volatils microbiens (MCOV), produits sur des matériaux de construction humides, peuvent contribuer à différents problèmes de santé, tels que l'irritation des yeux, du nez et de la gorge, la léthargie et les maux de tête {594}. Les études in vitro et in vivo démontrent que les spores dePenicillium et les extraits de spores peuvent expérimentalement induire une réponse immunomodulatrice significative des cellules du poumon ainsi qu'engendrer de l'inflammation chez des modèles animaux {951}.
Plus de détails
Un glucane non spécifique, le ß-1,3-D-glucane, est un composant structural non allergène de la paroi cellulaire de la plupart des mycètes : cette molécule semble jouer un rôle causal dans le développement des symptômes respiratoires liés à l'exposition fongique intérieure {1346}.
De plus, la roquefortine C peut stimuler des réponses inflammatoires in vivo et pourrait expliquer certains effets liés aux expositions en milieu intérieur à des spores de P. chrysogenum. De fait, expérimentalement chez la souris, la roquefortine C augmente le nombre de macrophages et de neutrophiles et la concentration de l'interleukine et des facteurs de nécrose tumorale dans le liquide de lavage bronchoalvéolaire {951}.
Réactions allergiques
Les Penicillium, des aéroallergènes très communs à l’extérieur et à l'intérieur, sont associés aux réactions allergiques de Type I, tels la rhinite allergique (rhume des foins) et l'asthme {2342, 3095}. Les tests de provocation bronchique avec des spores de Penicillium induisent des réactions asthmatiques de type immédiat et retardé chez des sujets sensibilisés {3166}. La sensibilisation aux moisissures peut mener à des crises graves d'asthme exigeant l'admission à l’hôpital {824}. Chez quelques patients, le Penicillium peut déclencher une réaction à IgE (IgE-dépendante) qui peut contribuer à l'exacerbation de l'eczéma.
Plus de détails
Toutefois, il faut interpréter avec prudence la pertinence clinique des mesures sérologiques des IgE antifongiques dans les cas d’allergies cutanées {2280, 3209}.
Les Penicillium dominent souvent la flore dans les échantillons d'air intérieur prélevés chez des patients asthmatiques sensibilisés aux moisissures; ils sont parfois trouvés en même temps que l'Aspergillus {3011, 623, 3022, 1566, 919, 3078}. Le Penicillium, seul ou en combinaison avec l'Aspergillus, est connu comme agent sensibilisant chez les enfants en bas âge {2669}, les enfants {2750, 915} et les adultes {915, 917, 855, 776}; cette sensibilisation est confirmée par des épreuves cutanées et sérologiques. L'exposition à des niveaux élevés de Penicillium constitue un risque significatif pour les sibilances (wheeze) et la toux persistante {1393, 913, 3029}. L'exposition au Penicillium en milieu intérieur a été associée à la sensibilisation de novo et aux symptômes allergiques, autant chez les enfants {3015} que chez les adultes {3066}, et son association spécifique à l'asthme pédiatrique ne fait plus de doute {2750}.
Plusieurs espèces de Penicillium possèdent des propriétés sensibilisantes menant à la production d’IgE ; les extraits des ces espèces démontrent des propriétés liantes à ces IgE; parmi les espèces les plus étudiées, il faut mentionner : le P. chrysogenum, le P. citrinum, le P. notatum, le P. oxalicum et le P. brevicompactum {3079, 3080}.
D’autres Penicillium sont également bien identifiés comme allergènes : le P. viridicatum, le P. expansum, le P. oxalicum,le P. paxilli {854}, le P. notatum (réaction croisée avec le P. camembertii) {3167, 2239}, le P. simplicissimum {1108} et leP. luteum {1288}.
Composés et mécanismes allergènes
Le P. chrysogenum est cité parmi les quatre mycètes les plus allergènes {624}. La petite taille (5 µm et moins) des conidies des Penicillium leur permet de demeurer en suspension dans l’air pendant des heures ainsi que de pénétrer profondément, lorsqu'elles sont inhalées, dans les voies respiratoires inférieures {903}. Certaines espèces ont plusieurs composants allergènes connus (notamment des sérines-protéases et des glycoprotéines) et peuvent induire des réponses allergiques chez des modèles animaux. Au moins trois protéines ont été identifiées comme allergènes lors de l'étude de leur réactivité avec des anticorps d'IgE provenant de sérums de patients asthmatiques {909}.
Les progrès en biologie moléculaire ont permis d’effectuer la caractérisation de fractions allergènes extraites de différentes espèces de Penicillium. Par exemple, voici certaines des composantes allergènes étudiées : les sérines protéases Pen ch 13 et Pen ch 18 (Pen n 18) extraite du Penicillium chrysogenum (P. notatum), les fractions Pen b 26 du P. brevicompactum {3328}, Pen o 18 du Penicillium oxalicum et Pen c 24 du P. citrinum.
Plus de détails
Les conidies de P. chrysogenum libèrent des enzymes protéolytiques qui, expérimentalement chez la souris, induisent et propagent à la fois l'inflammation allergique. Des injections intrapéritonéales d’extraits de conidies viables de Penicilliuminduisent chez la souris une augmentation significative des immunoglobulines totales sériques IgE et IgG. Subséquemment, les décomptes différentiels cellulaires de lavages bronchoalvéolaires démontrent une augmentation des éosinophiles et des neutrophiles. L'examen histopathologique des poumons révèle la présence d’une inflammation périvasculaire liée à l’augmentation des éosinophiles et des neutrophiles ainsi qu’une augmentation du mucus. Les conidies non viables ne semblent pas induire les mêmes réactions allergiques {925, 911}.
Vivre dans un environnement intérieur contaminé par des moisissures peut provoquer non seulement la sensibilisation spécifique aux moisissures, mais peut également augmenter l'allergie à d'autres allergènes environnementaux {945}. Il est vrai que l'exposition aux spores de Penicillium se produit aussi à l’extérieur, mais elle est bien moins importante que l’exposition en milieu intérieur contaminé ou en milieu de travail contaminé {27}. Il a été démontré que l’exposition chronique au P. chrysogenum, à des concentrations semblables à celles trouvées dans des bâtiments contaminés, peut induire des niveaux significatifs d'IgE totaux. De fait, une étude a démontré que l’instillation intranasale à long terme (six semaines) de conidies viables de P. chrysogenum, à des doses de 1 x 104 conidies (concentrations comparables à celles trouvées dans des bâtiments contaminés), produit des niveaux significatifs d'IgE totaux, alors que l'instillation de conidies non viables ne montre pas de changements significatifs; on a toutefois observé, dans les deux modèles, une augmentation d'IgG totaux {918}. L'inhalation à long terme de conidies viables peut induire des réponses inflammatoires comme celles observées dans les réactions asthmatiques allergiques. Toutefois, exposées à un nombre inférieur de conidies viables (1 x 102), les souris ne développent pas de symptômes allergiques; ceci suggère que l'exposition à de faibles concentrations de conidies viables, telles que celles trouvées dans les bâtiments non contaminés, n'induit pas de sensibilisation allergique {903}.
Pneumonite d'hypersensibilité
Les pneumonites d'hypersensibilité (HP) ou réactions de Type III, provoquées par l’exposition aux Penicillium, sont reconnues comme des maladies professionnelles et sont même décrites dans le répertoire des définitions nosologiques intitulé Classification statistique internationale des maladies et des problèmes de santé connexes (ICD-10) en tant qu’alvéolites allergiques à la rubrique J67.9. Certains cas d'exposition professionnelle agricole à Penicillium ainsi que quelques plus rares cas d’exposition en milieu intérieur contaminé sont reconnus pour induire une HP. Plusieurs espèces de Penicillium ont été associées aux symptômes de la HP. Les symptômes de fatigue et de dyspnée accompagnée d’une légère fièvre (température subfébrile) ressentis dans un environnement spécifique de travail ont été associés à des expositions à des espèces de Penicillium, telles que le P. camembertii, le P. notatum {3054}, le P. roquefortii {3239} et leP. verrucosum {3034}.
Plus de détails
Différents mycètes et différentes bactéries présents dans l'eau peuvent provoquer un syndrome connu sous le nom depoumon d'humidificateur chez des sujets exposés : des études ont démontré que, dans ces cas, près d'un quart des sujets symptomatiques ont des IgG spécifiques dirigés contre des extraits de Penicillium notatum isolés de l’eau incriminée {277, 3010}. D'autres expositions environnementales en milieu intérieur aux Penicillium ont été associées à la HP fongique {3014, 1403}.
Effets toxiques (mycotoxicoses)
La plupart des espèces de Penicillium sont de bonnes productrices de toxines lorsque l’ensemble des conditions de croissance favorables est réuni. L’ingestion de toxines fabriquées par les Penicillium produit notamment des effets cytotoxiques, néphrotoxiques et trémorgènes et, parfois, des effets immunosuppressifs et cancérogènes. Ces pathologies sont bien connues pour se produire chez l'homme, le bétail et d'autres animaux {3182, 3184, 1615}. Conséquemment, la concentration en mycotoxines dans les aliments pour le bétail et dans la nourriture destinée à la consommation humaine est strictement réglementée {3191, 3190, 3189}.
Plus de détails
L'ochratoxine A, pouvant être produite par le P. verrucosum, est néphrotoxique et cancérogène. La verrucosidine, une autre mycotoxine produite par ce mycète, est aussi néphrotoxique. L'acide pénicillique est également une mycotoxine néphrotoxique, toutefois elle peut en plus être hépatotoxique {801, 1550}.
La roquefortine C est considérée comme une substance cytotoxique et est faiblement neurotoxique {948}. Elle est reconnue comme un produit toxique, surtout dans la nourriture animale, où elle a été mise en cause dans des cas de mortalité chez le bétail {950}. Keblys et al. {948} ont démontré que la roquefortine C peut causer, in vitro, l'inhibition de souches de lymphocytes porcins. Cependant, une étude de Bünger et al. {949} affirme que la roquefortine C a une toxicité négligeable lorsqu’elle est ingérée par les humains. Les chercheurs n'ont observé aucune cytotoxicité concernant cette molécule aux concentrations solubles; ce manque apparent de toxicité peut être dû à la faible disponibilité biologique de la molécule.
L'étude d'agrégats de cas de néoplasmes humains et de leucémie bovine a démontré que la présence duP. meleagrinum dans le milieu de vie des sujets pourrait être un facteur de risque pour ces cancers {2416, 1826}.
Des études expérimentales réalisées sur la poussière domestique ont prouvé que, sur les cellules de trachée de poulet, les exométabolites et les endométabolites extractibles dans le chloroforme sont des produits ciliostatiques très efficaces {3181, 3180, 3179}. Dans ces études, ce sont les métabolites d’espèces de Penicillium, provenant de la poussière domestique, qui ont montré le niveau le plus élevé de toxicité dans les modèles in vitro {550, 2392}.
Infection et colonisation
Les infections humaines à Penicillium sont rares; des infections de type opportuniste menant à des cas d’infections respiratoires, de kératites fongiques, d'otomycoses et d'endocardites ont été rapportées. Les infections bronchopulmonaires sont les formes les plus souvent rapportées {3215}, et des nodules pulmonaires asymptomatiques ont également été observés {3216}.
Plus de détails
Une revue de littérature faite sur une période de 50 ans montre la diversité de ces infections. Depuis 1951, on a rapporté trente et un cas d’infections invasives, dont douze cas d'infections pulmonaires (six chez des patients non immunocompromis), six cas d'endocardites prosthétiques de valve, six cas de péritonites DPCA (dialyse péritonéale continue ambulatoire), cinq cas d'endophtalmites et finalement un cas de chacune des infections suivantes : fongémie, œsophagite, infection urinaire haute et infection intracrânienne. Les traumatismes, la chirurgie ou le matériel prosthétique sont généralement impliqués dans les autres sites que les poumons. Par contre, les infections superficielles (kératite ou otomycose) à Penicillium sont plus fréquentes {3242}. Parmi les cas plus rares d’infections invasives, il faut aussi noter un cas d'infection pulmonaire à Penicillium sp. chez un patient souffrant de granulomatose chronique, un cas de maladie cérébrale provoquée par un P. chrysogenum de source inconnue et une infection périopératoire à P. decumbens avec infection paravertébrale; des cas isolés d'ulcère cornéen, d'infection de la paroi de la vessie {1951} et de mastoïdite chronique {3219} de même qu'un cas d'infection invasive à Penicillium sp. (compatible avec un P. marneffei) chez un patient leucémique en phase aiguë {3220}.
Les nombreux sites anatomiques touchés par ces infections suggèrent que le Penicillium pourrait se propager autant par la voie sanguine que par le passage direct à travers les muqueuses {901}.
Plus récemment, des infections pulmonaires et invasives ont également été rapportées chez des personnes atteintes du sida : dans ces cas, il s’agit d’infections à P. marneffei {3035, 3195}. Le P. marneffei n'a jamais encore été rapporté dans les bâtiments contaminés. Chez l'homme, l'infection à Penicillium par une autre espèce que le P. marneffei est rare. En fait, les autres espèces de Penicillium sont rarement les agents étiologiques d'infections invasives documentées, bien qu'on identifie de plus en plus les Penicillium spp. comme des opportunistes potentiels chez les hôtes immunocompromis {926}, particulièrement chez ceux atteints du VIH ou prenant des immunosuppresseurs; cesPenicillium sont rarement identifiés comme des agents infectieux chez les sujets immunocompétents {901}. Cependant, le P. chrysogenum est sporadiquement impliqué dans des cas d’infection chez des sujets dont l'immunosuppression n'a pu être prouvée; ainsi, on a rapporté, chez des sujets apparemment immunocompétents, des cas d’otomycoses, d'endophtalmites, de kératites, d'endocardites et d'infections cutanées {936} ainsi qu’un cas de pneumonie {926}.
Facteur de virulence
Aucun facteur de virulence particulier n’est rapporté pour les Penicillium, si ce n’est le potentiel dimorphique propre auP. marneffei.
Plus de détails
Le pouvoir infectieux distinct de P. marneffei dépend de sa transformation morphologique au moment de l'invasion des tissus, c'est-à-dire du passage de sa forme mycélienne saprophyte environnementale à sa forme invasive levuriforme. La forme in vivo de ce mycète, qui apparaît lors du passage dans un environnement à 37 °C, se reproduit par fission comme une levure, ce qui lui permet de se dérober habilement au système immunitaire de l’hôte {3193, 3194, 3195}.
Bien que les autres Penicillium ne semblent pas posséder de facteurs de virulence propres, l'exposition à des niveaux élevés de Penicillium aéroporté pourrait augmenter le risque de développer des maladies des voies respiratoires inférieures pendant la première année de la vie {1462}.
Milieux particuliers
Infections nosocomiales
Le Penicillium est souvent rapporté comme étant le principal mycète dans les échantillons d'air contaminé prélevés dans les hôpitaux {2409, 2080, 3009, 3031}. Étant donné que ce mycète prolifère facilement sur les matériaux de construction absorbants {3055, 527}, on a même suggéré d'utiliser sa concentration comme index de contamination {3009}. Toutefois, les Penicillium sont très rarement impliqués dans les infections nosocomiales : ces rares cas d'infections se produisent en période postopératoire ou par transmission iatrogénique chez des patients immunocompromis. Des échantillons de tissu de granulation, prélevés chez deux patients présentant une sténose post-intubation, ont permis de confirmer la présence deP. sp. par examen microscopique et par culture {3131}.
Plus de détails
Deux cas d'infections de plaies chirurgicales, provoquées par des espèces de Penicillium, ont été attribués au système de ventilation d'une salle d’opération, dont les gaines de fibre de verre étaient fortement contaminées par du Penicillium{527}; la fibre de verre était également contaminée par des espèces d'Aspergillus.
De très rares cas d’infections par des Penicillium de l'environnement ont été rapportés en milieu hospitalier. La seule espèce de Penicillium fréquemment rapportée chez les patients immunosupprimés est le P. marneffei, et celui-ci ne semble pas se développer sur des matériaux de construction : tous les cas à P. marneffei semblent être acquis dans la communauté. En outre, ce type d'infections est la plupart du temps limité aux pays de l’Extrême-Orient {373}; quelques cas d'infections contractées à l'étranger ont été rapportés aux États-Unis, au Canada {3075} et en Australie {3035}. De plus, le P. marneffei ne peut pas être confondu avec d'autres types d'infections à Penicillium étant donné que sa présentation histopathologique est typique et que ses caractéristiques mycologiques diphasiques rendent ce Penicilliumfacilement reconnaissable; de plus, l'infection se produit tardivement chez les patients sidéens ou immunocompromis {3195}.
Maladies professionnelles
Les pneumonites d'hypersensibilité de Type III (HP), provoquées par les Penicillium, sont bien connues en milieu de travail; parmi ces pneumonites, il faut mentionner le poumon des fromagers {3239, 3034, 3048}, le poumon du fabricant de saucisses {3167, 3211}, le poumon du bûcheron ou le poumon des scieries. Les expositions en milieu sylvicole et agricole, aussi bien que celles en serriculture et dans les usines de compostage, sont reconnues comme des facteurs de risque professionnels liés à des problèmes respiratoires tels que la HP {776, 775}. Il en va de même pour les préposés aux soins des animaux {709} et les ouvriers de la construction {766, 695, 3066, 2841, 3122}.
Plus de détails
Certaines maladies respiratoires ont souvent été associées à l’industrie du bois, aux scieries et aux ateliers de menuiserie {3003, 1786, 3024, 957, 858, 775, 776, 1581} : plusieurs de ces cas de HP ont été associés à la contamination (bois de hêtre, panneaux d’aggloméré ou carton gris) par différentes espèces de Penicillium {858}.
La HP à Penicillium est également fréquente dans les environnements agricoles confinés {1786, 862} où les expositions significatives sont associées en particulier au déchargement et à la manipulation des grains {2500}.
Dans les serres de production, les plantations peuvent héberger une croissance fongique abondante qui peut devenir aéroportée, surtout lorsque les plantes sont agitées directement : les aérosols générés comprennent principalement des espèces de Cladosporium et de Penicillium {1822, 2765}.
De même, plusieurs espèces de Penicillium sont trouvées, avec d'autres mycètes, en grande concentration dans les usines de compostage et de traitement des boues résiduelles; les allergènes et les immunogènes fongiques ainsi que les métabolites de ces espèces représentent un risque sanitaire {2809, 1148, 3092, 855}.
Les milieux agroalimentaires ne représentent pas tous le même haut niveau d’exposition. Par exemple, les cultures de houblon contiennent généralement des Penicillium et de l'Alternaria, mais en concentrations inférieures aux autres types de cultures : les décomptes totaux relativement plus faibles peuvent être partiellement attribuables aux propriétés antimicrobiennes du houblon {2654}.
Le P. verrucosum a été identifié comme agent causal d’un syndrome respiratoire, très semblable à l'alvéolite allergique extrinsèque, chez les ouvriers d'une fromagerie {3034}.
Des espèces de Penicillium sont aussi les agents de plusieurs cas de HP chez les boulangers. Les Penicillium sont les mycètes les plus abondants à certains postes de travail dans les boulangeries, et ce, du moins au printemps {2401, 2023, 1731, 1078, 2001}.
Une étude a prouvé que le Penicillium citrinum devrait être considéré en tant qu'allergène professionnel potentiel pour les préposés à la transformation de la pomme de terre; dans ce cas-ci, le mécanisme délétère est probablement une stimulation d’une réaction immunopathologique défavorable {3026}.
Dans les usines de métallurgie, des espèces de Penicillium, d'Aspergillus et de Cladosporium ont été relevées dans l’air avoisinant les postes de travail, où sont utilisés des fluides de métallurgie (fluides de coupe, fluides d’usinage), mais rarement dans les fluides eux-mêmes; la présence de ces mycètes ne serait toutefois pas aussi significative que celle des endotoxines et des anticorps IgG antibactériens comme indicateurs de l'exposition professionnelle aux contaminants microbiens dans ce type de travail. {229}.
Les concentrations de Penicillium mesurées dans des échantillons d'air prélevés dans des bibliothèques et des lieux d’entreposage d’archives sont à des niveaux tels qu’ils pourraient représenter un risque pour la santé des employés {2774}.
Le travail de démolition et de rénovation peut constituer un risque professionnel pour des ouvriers de la construction parce que des matériaux de construction peuvent être fortement contaminés par des moisissures, en particulier par lePenicillium et le Stachybotrys; cette contamination pouvant être visible ou cachée. Conséquemment, quand une telle contamination est suspectée, ce type de travail requiert le port d’équipements de protection personnelle (EPP) appropriés {695} et la mise en place de mesures de confinement adéquat {1855}. Il serait nécessaire d'effectuer d'autres études pour déterminer tous les effets sur la santé associés à ce type de bioaérosols et de mycotoxines auxquels sont fréquemment exposés les ouvriers de la construction {216}.
Outils de diagnostic
Histopathologie
La présentation histologique d'une infection profonde à P. marneffei est typiquement celle d'une infection fongique profonde à champignon dimorphe, caractérisée par la présence d’éléments levuriformes. Une infection invasive engendrée par d'autres Penicillium ressemble à une infection opportuniste à champignon mycélien, caractérisée par la présence d’éléments mycéliens plus ou moins complets.
Immunodiagnostic
Les antigènes courants disponibles commercialement pour utilisation in vivo et <="" em="">sont ceux du P. camembertii, du P. chrysogenum (P. notatum), du P. digitatum, du P. expansum, du P. glabrum, du P. glaucum, du P. roseum, du P. roquefortiiet du P. rubrum {2758, 581, 3284 }.
Plus de détails
Certains extraits allergènes des Penicillium font partie du programme américain de surveillance de la Federal Drug Administration (FDA) des États-Unis et du Biological Products Deviation Reporting. Non-Blood Product Codes (registre des substances biologiques fongiques recevant les rapports concernant la non-conformité de produits [traduction libre]) {3285}.
- GK23 - Penicillium atramentosum
- GK24 - Penicillium biforme
- GK25 - Penicillium camemberti
- GK26 - Penicillium carmino-violaceum
- GK27 - Penicillium chrysogenum
- GK28 - Penicillium digitatum
- GK29 - Penicillium expansum
- GK30 - Penicillium funiculosum
- GK31 - Penicillium glaucum
- GK32 - Penicillium glaucus
- GK33 - Penicillium intricatum
- GK34 - Penicillium italicum
- GK35 - Penicillium janthinellum
- GK36 - Penicillium luteum
- GK37 - Penicillium notatum
- GK38 - Penicillium oxalicum
- GK39 - Penicillium roqueforti
- GK40 - Penicillium roseo-purpureum
- GK41 - Penicillium roseum
- GK42 - Penicillium rubrum
- GK43 - Penicillium sp.
- GK44 - Penicillium vermiculatum
Liste constituée à partir du registre de l’année 2008 de la Federal Drug Administration (FDA), qui permet de faire le suivi des substances biologiques homologuées, soit le Biological Products Deviation Reporting. Non-Blood Product Codes {3285}.
Épreuves immunodiagnostiques disponibles
| Épreuve | IgE | IgG | Antigènes | Autre |
|---|---|---|---|---|
| Cuti-réactions | X | |||
| RAST-IgE | X | |||
| RAST-IgG | X | |||
| ELISA-ELIFA | N/D | |||
| Immunodiffusion | N/D | |||
| Immunofluorescence | Expérimental | |||
| Fixation du complément | N/D | |||
| PCR | Expérimental | |||
| Autre |
Bibliographie
- 27. Salvaggio, J. E., Burge, H. A., and Chapman, J. A. (1993). Emerging concepts in mold allergy: what is the role of immunotherapy? J Allergy Clin Immunol. 92, 217-222.
- 216. Trout, D., Bernstein, J., Martinez, K., Biagini, R., and Wallingford, K. (2001). Bioaerosol lung damage in a worker with repeated exposure to fungi in a water-damaged building. Environ Health Perspect. 109[6], 641-644.
- 229. Laitinen, S., Linnainmaa, M., Laitinen, J., Kiviranta, H., Reiman, M., and Liesivuori, J. (1999). Endotoxins and IgG antibodies as indicators of occupational exposure to the microbial contaminants of metal-working fluids. Int Arch Occup.Environ Health. 72[7], 443-450.
- 277. Baur, X., Richter, G., Pethran, A., Czuppon, A. B., and Schwaiblmair, M. (1992). Increased prevalence of IgG-induced sensitization and hypersensitivity pneumonitis (humidifier lung) in nonsmokers exposed to aerosols of a contaminated air conditioner. Respiration. 59[4], 211-214.
- 315. Rao, C. Y., Cox-Ganser, J. M., Chew, G. L., Doekes, G., and White, S. (2005). Use of surrogate markers of biological agents in air and settled dust samples to evaluate a water-damaged hospital. Indoor.Air. 15 Suppl 9:89-97., 89-97.
- 373. Hsueh, P. R., Teng, L. J., Hung, C. C., Hsu, J. H., Yang, P. C., Ho, S. W., and Luh, K. T. (2000). Molecular evidence for strain dissemination of Penicillium marneffei: an emerging pathogen in Taiwan. J Infect Dis. 181[5], 1706-1712.
- 412. Larone, D H. (1987). Medically important fungi. A guide to identification. 2nd edition, -230 p. New York - Amsterdam - London, Elsevier Science Publishing Co., Inc.
- 413. Storey, E, Dangman, K H, Schenck, P, DeBernardo, R L, Yang, C S, Bracker, A, and Hodgson, M J. (2004). Guidance for clinicians on the recognition and management of health effects related to mold exposure and moisture indoors. -58 p. Farmington, Center for Indoor Environment and Health, University of Connecticut Health Center.
- 470. Texas Tech University and Health Sciences Center. (2006). Fungal glossary with abstracts. Department of Microbiology and Immunology. http://www.ttuhsc.edu/ . Texas Tech University Health Sciences Center. 12-12-0006.
- 527. Fox, B. C., Chamberlin, L., Kulich, P., Rae, E. J., and Webster, L. R. (1990). Heavy contamination of operating room air by Penicillium species: identification of the source and attempts at decontamination. Am J Infect Control. 18[5], 300-306.
- 550. Pieckova, E. and Wilkins, K. (2004). Airway toxicity of house dust and its fungal composition. Ann Agric.Environ Med. 11[1], 67-73.
- 575. Dales, R. E., Miller, D., and McMullen, E. (1997). Indoor air quality and health: validity and determinants of reported home dampness and moulds. Int J Epidemiol. 26[1], 120-125.
- 581. Pharmacia Diagnostics AB. (2007). Allergy & autoimmunity. Diagnostics product catalogue 2007. internet , 1-48. Pharmacia.
- 587. Krause, M., Geer, W., Swenson, L., Fallah, P., and Robbins, C. (2006). Controlled study of mold growth and cleaning procedure on treated and untreated wet gypsum wallboard in an indoor environment. J Occup.Environ Hyg. 3[8], 435-441.
- 594. Claeson, A. S., Levin, J. O., Blomquist, G., and Sunesson, A. L. (2002). Volatile metabolites from microorganisms grown on humid building materials and synthetic media. J Environ Monit. 4[5], 667-672.
- 603. Nielsen, K. F., Gravesen, S., Nielsen, P. A., Andersen, B., Thrane, U., and Frisvad, J. C. (1999). Production of mycotoxins on artificially and naturally infested building materials. Mycopathologia. 145[1], 43-56.
- 605. Gravesen, S., Nielsen, P. A., Iversen, R., and Nielsen, K. F. (1999). Microfungal contamination of damp buildings--examples of risk constructions and risk materials. Environ Health Perspect. 107 Suppl 3:505-8., 505-508.
- 606. Andersson, M. A., Nikulin, M., Koljalg, U., Andersson, M. C., Rainey, F., Reijula, K., Hintikka, E. L., and Salkinoja-Salonen, M. (1997). Bacteria, molds, and toxins in water-damaged building materials. Appl.Environ Microbiol. 63[2], 387-393.
- 607. Sunesson, A. L., Nilsson, C. A., Andersson, B., and Blomquist, G. (1996). Volatile metabolites produced by two fungal species cultivated on building materials. Ann Occup.Hyg. 40[4], 397-410.
- 620. Chew, G. L., Wilson, J., Rabito, F. A., Grimsley, F., Iqbal, S., Reponen, T., Muilenberg, M. L., Thorne, P. S., Dearborn, D. G., and Morley, R. L. (2006). Mold and endotoxin levels in the aftermath of Hurricane Katrina: a pilot project of homes in New Orleans undergoing renovation. Environ Health Perspect. 114[12], 1883-1889.
- 623. Ceylan, E., Ozkutuk, A., Ergor, G., Yucesoy, M., Itil, O., Caymaz, S., and Cimrin, A. (2006). Fungi and indoor conditions in asthma patients. J Asthma. 43[10], 789-794.
- 624. de Ana, S. G., Torres-Rodriguez, J. M., Ramirez, E. A., Garcia, S. M., and Belmonte-Soler, J. (2006). Seasonal distribution of Alternaria, Aspergillus, Cladosporium and Penicillium species isolated in homes of fungal allergic patients. J Investig.Allergol.Clin Immunol. 16[6], 357-363.
- 670. Godish, T. J. and Godish, D. R. (2006). Mold infestation of wet spray-applied cellulose insulation. J Air Waste Manag.Assoc. 56[1], 90-95.
- 695. Rao, C. Y., Riggs, M. A., Chew, G. L., Muilenberg, M. L., Thorne, P. S., Sickle, D. V., Dunn, K. H., and Brown, C. (2007). Characterizing airborne molds, endotoxins and glucans in homes in New Orleans after Hurricanes Katrina and Rita. Appl.Environ Microbiol. .
- 709. Wilson, S. C. and Straus, D. C. (2002). The presence of fungi associated with sick building syndrome in North American zoological institutions. J Zoo.Wildl.Med. 33[4], 322-327.
- 724. Samson, RA, Hoekstra, ES, and et al. (1984). Introduction to food and airbone fungi. 6th, -389 p. Baarn, Centralalbureau voor Schimmellcultures, Institute of the Royal Netherlands Academy of Arts and Sciences.
- 725. Gravesen, S., Frisvad, J. C., and Samson, RA. (1994). Microfungi. 1st edition, -168 p. Copenhagen, Munksgaard.
- 766. Park, J. H., Cox-Ganser, J., Rao, C., and Kreiss, K. (2006). Fungal and endotoxin measurements in dust associated with respiratory symptoms in a water-damaged office building. Indoor Air. 16[3], 192-203.
- 775. Dutkiewicz, J., Skorska, C., Dutkiewicz, E., Matuszyk, A., Sitkowska, J., and Krysinska-Traczyk, E. (2001). Response of sawmill workers to work-related airborne allergens. Ann Agric Environ Med. 8[1], 81-90.
- 776. Dutkiewicz, J., Krysinska-Traczyk, E., Prazmo, Z., Skorska, C., and Sitkowska, J. (2001). Exposure to airborne microorganisms in Polish sawmills. Ann Agric Environ Med. 8[1], 71-80.
- 795. Fog, Nielsen K. (2003). Mycotoxin production by indoor molds. Fungal.Genet.Biol. 39[2], 103-117.
- 798. Andersen, B., Smedsgaard, J., and Frisvad, J. C. (2004). Penicillium expansum: consistent production of patulin, chaetoglobosins, and other secondary metabolites in culture and their natural occurrence in fruit products. J Agric.Food Chem. 52[8], 2421-2428.
- 801. Hodge, R. P., Harris, C. M., and Harris, T. M. (1988). Verrucofortine, a major metabolite of Penicillium verrucosum var. cyclopium, the fungus that produces the mycotoxin verrucosidin. J Nat.Prod. 51[1], 66-73.
- 808. Al-Doory, Y and Domson, JF. (1984). Mould allergy. Lea & Febiger.
- 814. Ellis, D. (2007). Mycology online. University of Adelaide . School of molecular & biomedical science. The University of Adelaide.
- 816. Patterson, T. F., McGinnis, M. R., and ed. (2009). The fungi :description. Site Doctor Fungus . Mycoses Study Group.
- 824. Denning, D. W., O'Driscoll, B. R., Hogaboam, C. M., Bowyer, P., and Niven, R. M. (2006). The link between fungi and severe asthma: a summary of the evidence. Eur Respir.J. 27[3], 615-626.
- 854. Lugauskas, A., Krikstaponis, A., and Sveistyte, L. (2004). Airborne fungi in industrial environments--potential agents of respiratory diseases. Ann Agric.Environ Med. 11[1], 19-25.
- 855. Prazmo, Z., Krysinska-Traczyk, E., Skorska, C., Sitkowska, J., Cholewa, G., and Dutkiewicz, J. (2003). Exposure to bioaerosols in a municipal sewage treatment plant. Ann Agric.Environ Med. 10[2], 241-248.
- 858. Dutkiewicz, J., Olenchock, S., Krysinska-Traczyk, E., Skorska, C., Sitkowska, J., and Prazmo, Z. (2001). Exposure to airborne microorganisms in fiberboard and chipboard factories. Ann Agric.Environ Med. 8[2], 191-199.
- 862. Cormier, Y., Tremblay, G., Meriaux, A., Brochu, G., and Lavoie, J. (1990). Airborne microbial contents in two types of swine confinement buildings in Quebec. Am Ind.Hyg.Assoc.J. 51[6], 304-309.
- 877. Cardinal, L and al. (2003). Programme national de santé publique 2003-2012 (PNSP). Massé, R and Gilbert, L. msss.qc.ca . Québec, Direction générale de la santé publique, Ministère de la Santé et des Services sociaux.
- 901. Barcus, A. L., Burdette, S. D., and Herchline, T. E. (2005). Intestinal invasion and disseminated disease associated with Penicillium chrysogenum. Ann Clin Microbiol Antimicrob. 4:21., 21.
- 902. Purdy, C. W., Layton, R. C., Straus, D. C., and Ayers, J. R. (2005). Virulence of fungal spores determined by tracheal inoculation of goats following inhalation of aerosolized sterile feedyard dust. Am J Vet.Res. 66[4], 615-622.
- 903. Schwab, C. J., Cooley, J. D., Brasel, T., Jumper, C. A., Graham, S. C., and Straus, D. C. (2003). Characterization of exposure to low levels of viable Penicillium chrysogenum conidia and allergic sensitization induced by a protease allergen extract from viable P. Chrysogenum conidia in mice. Int Arch Allergy Immunol. 130[3], 200-208.
- 904. Lopez-Martinez, R., Neumann, L., and Gonzalez-Mendoza, A. (1999). Case report: cutaneous penicilliosis due to Penicillium chrysogenum. Mycoses. 42[4], 347-349.
- 909. Chung, Y. J., Coates, N. H., Viana, M. E., Copeland, L., Vesper, S. J., Selgrade, M. K., and Ward, M. D. (2005). Dose-dependent allergic responses to an extract of Penicillium chrysogenum in BALB/c mice. Toxicology. 209[1], 77-89.
- 911. Instanes, C., Ormstad, H., Rydjord, B., Wiker, H. G., and Hetland, G. (2004). Mould extracts increase the allergic response to ovalbumin in mice. Clin Exp.Allergy. 34[10], 1634-1641.
- 913. Hyvarinen, A., Husman, T., Laitinen, S., Meklin, T., Taskinen, T., Korppi, M., and Nevalainen, A. (2003). Microbial exposure and mold-specific serum IgG levels among children with respiratory symptoms in 2 school buildings. Arch Environ Health. 58[5], 275-283.
- 915. Chou, H., Chang, C. Y., Tsai, J. J., Tang, R. B., Lee, S. S., Wang, S. R., Peng, H. J., and Shen, H. D. (2003). The prevalence of IgE antibody reactivity against the alkaline serine protease major allergen of Penicillium chrysogenum increases with the age of asthmatic patients. Ann Allergy Asthma Immunol. 90[2], 248-253.
- 917. Lander, F., Meyer, H. W., and Norn, S. (2001). Serum IgE specific to indoor moulds, measured by basophil histamine release, is associated with building-related symptoms in damp buildings. Inflamm.Res. 50[4], 227-231.
- 918. Cooley, J. D., Wong, W. C., Jumper, C. A., Hutson, J. C., Williams, H. J., Schwab, C. J., and Straus, D. C. (2000). An animal model for allergic penicilliosis induced by the intranasal instillation of viable Penicillium chrysogenum conidia. Thorax. 55[6], 489-496.
- 919. Shen, H. D., Lin, W. L., Tam, M. F., Wang, S. R., Tzean, S. S., Huang, M. H., and Han, S. H. (1999). Characterization of allergens from Penicillium oxalicum and P. notatum by immunoblotting and N-terminal amino acid sequence analysis. Clin Exp.Allergy. 29[5], 642-651.
- 925. Schwab, C. J., Cooley, J. D., Jumper, C. J., Graham, S. C., and Straus, D. C. (2004). Allergic inflammation induced by a Penicillium chrysogenum conidia-associated allergen extract in a murine model. Allergy. 59[7], 758-765.
- 926. D'Antonio, D., Violante, B., Farina, C., Sacco, R., Angelucci, D., Masciulli, M., Iacone, A., and Romano, F. (1997). Necrotizing pneumonia caused by Penicillium chrysogenum. J Clin Microbiol. 35[12], 3335-3337.
- 927. Rundberget, T., Skaar, I., and Flaoyen, A. (2004). The presence of Penicillium and Penicillium mycotoxins in food wastes. Int J Food Microbiol. 90[2], 181-188.
- 934. Galland, F., le Goff, L., Conrath, J., and Ridings, B. (2004). [Penicillium chrysogenum endophthalmitis: a case report]. J Fr Ophtalmol. 27[3], 264-266.
- 936. Kantarcioglu, A. S., Apaydin, H., Yucel, A., de Hoog, G. S., Samson, R. A., Vural, M., and Ozekmekci, S. (2004). Central nervous system infection due to Penicillium chrysogenum. Mycoses. 47[5-6], 242-248.
- 947. Wilkins, K., Larsen, K., and Simkus, M. (2000). Volatile metabolites from mold growth on building materials and synthetic media. Chemosphere. 41[3], 437-446.
- 948. Keblys, M., Bernhoft, A., Hofer, C. C., Morrison, E., Larsen, H. J., and Flaoyen, A. (2004). The effects of the Penicillium mycotoxins citrinin, cyclopiazonic acid, ochratoxin A, patulin, penicillic acid, and roquefortine C on in vitro proliferation of porcine lymphocytes. Mycopathologia. 158[3], 317-324.
- 949. Bunger, J., Westphal, G., Monnich, A., Hinnendahl, B., Hallier, E., and Muller, M. (2004). Cytotoxicity of occupationally and environmentally relevant mycotoxins. Toxicology. 202[3], 199-211.
- 950. Aninat, C., Andre, F., and Delaforge, M. (2005). Oxidative metabolism by P450 and function coupling to efflux systems: modulation of mycotoxin toxicity. Food Addit.Contam. 22[4], 361-368.
- 951. Rand, T. G., Giles, S., Flemming, J., Miller, J. D., and Puniani, E. (2005). Inflammatory and cytotoxic responses in mouse lungs exposed to purified toxins from building isolated Penicillium brevicompactum Dierckx and P. chrysogenum Thom. Toxicol.Sci. 87[1], 213-222.
- 957. Duchaine, C., Meriaux, A., Thorne, P. S., and Cormier, Y. (2000). Assessment of particulates and bioaerosols in eastern Canadian sawmills. AIHAJ. 61[5], 727-732.
- 989. Centre de recherche sur la conservation des documents graphiques. (2007). Moisissures et biens culturels. Ministère de la culture et de la Communication, France .
- 997. Lugauskas, A. (2005). Potential toxin producing micromycetes on food raw material and products of plant origin. Botanica Lithuanica [Suppl. 7], 3-16.
- 1037. Park, J. H., Schleiff, P. L., Attfield, M. D., Cox-Ganser, J. M., and Kreiss, K. (2004). Building-related respiratory symptoms can be predicted with semi-quantitative indices of exposure to dampness and mold. Indoor Air. 14[6], 425-433.
- 1056. Samson, RA, Hoekstra, ES, and Frisvad, JC. (2004). Introduction to food and airbone fungi. 7th, -389 p. Baarn, Centralalbureau voor Schimmellcultures, Institute of the Royal Netherlands Academy of Arts and Sciences.
- 1066. Burge, H. A. (2001). Fungi: toxic killers or unavoidable nuisances? Ann Allergy Asthma Immunol. 87[6 Suppl 3], 52-56.
- 1072. Chew, G. L., Rogers, C., Burge, H. A., Muilenberg, M. L., and Gold, D. R. (2003). Dustborne and airborne fungal propagules represent a different spectrum of fungi with differing relations to home characteristics. Allergy. 58[1], 13-20.
- 1078. Levy, J. I., Nishioka, Y., Gilbert, K., Cheng, C. H., and Burge, H. A. (1999). Variabilities in aerosolizing activities and airborne fungal concentrations in a bakery. Am Ind.Hyg.Assoc.J. 60[3], 317-325.
- 1108. Mackiewicz, B., Skorska, C., Dutkiewicz, J., Michnar, M., Milanowski, J., Prazmo, Z., Krysinska-Traczyk, E., and Cisak, E. (1999). Allergic alveolitis due to herb dust exposure. Ann Agric.Environ Med. 6[2], 167-170.
- 1148. Fischer, G., Muller, T., Schwalbe, R., Ostrowski, R., and Dott, W. (2000). Species-specific profiles of mycotoxins produced in cultures and associated with conidia of airborne fungi derived from biowaste. Int J Hyg.Environ Health. 203[2], 105-116.
- 1203. Pitt, J. I., Basilico, J. C., Abarca, M. L., and Lopez, C. (2000). Mycotoxins and toxigenic fungi. Med Mycol. 38 Suppl 1:41-6., 41-46.
- 1220. Skaug, M. A., Eduard, W., and Stormer, F. C. (2001). Ochratoxin A in airborne dust and fungal conidia. Mycopathologia. 151[2], 93-98.
- 1288. Liang, K. L., Su, M. C., and Jiang, R. S. (2006). Comparison of the skin test and ImmunoCAP system in the evaluation of mold allergy. J Chin Med Assoc. 69[1], 3-6.
- 1346. Douwes, J. (2005). (1-->3)-Beta-D-glucans and respiratory health: a review of the scientific evidence. Indoor Air. 15[3], 160-169.
- 1393. Husman, T. (1996). Health effects of indoor-air microorganisms. Scand.J Work Environ Health. 22[1], 5-13.
- 1403. Park, H. S., Jung, K. S., Kim, S. O., and Kim, S. J. (1994). Hypersensitivity pneumonitis induced by Penicillium expansum in a home environment. Clin Exp Allergy. 24[4], 383-385.
- 1462. Stark, P. C., Burge, H. A., Ryan, L. M., Milton, D. K., and Gold, D. R. (2003). Fungal levels in the home and lower respiratory tract illnesses in the first year of life. Am J Respir Crit Care Med. 168[2], 232-237.
- 1534. Donohue, M., Chung, Y., Magnuson, M. L., Ward, M., Selgrade, M. J., and Vesper, S. (2005). Hemolysin chrysolysin from Penicillium chrysogenum promotes inflammatory response. Int J Hyg Environ Health. 208[4], 279-285.
- 1550. Skaug, M. A. (2003). Levels of ochratoxin A and IgG against conidia of Penicillium verrucosum in blood samples from healthy farm workers. Ann Agric Environ Med. 10[1], 73-77.
- 1566. Shen, H. D., Tam, M. F., Tang, R. B., and Chou, H. (2007). Aspergillus and Penicillium allergens: focus on proteases. Curr Allergy Asthma Rep. 7[5], 351-356.
- 1578. Brandi, G., Sisti, M., Paparini, A., Gianfranceschi, G., Schiavano, G. F., De, Santi M., Santoni, D., Magini, V., and Romano-Spica, V. (2007). Swimming pools and fungi: an environmental epidemiology survey in Italian indoor swimming facilities. Int J Environ Health Res. 17[3], 197-206.
- 1581. Guerrera, E., Frusteri, L., Giovinazzo, R., Mariani, M., and Pitzurra, L. (2006). [Presence of the microbiological risk in Umbrian sawmills]. G.Ital.Med Lav.Ergon. 28[4], 466-471.
- 1582. Barnes, C. S., Dowling, P., Van, Osdol T., and Portnoy, J. (2007). Comparison of indoor fungal spore levels before and after professional home remediation. Ann Allergy Asthma Immunol. 98[3], 262-268.
- 1615. Kendra, D. F. and Dyer, R. B. (2007). Opportunities for biotechnology and policy regarding mycotoxin issues in international trade. Int J Food Microbiol. %20;119[1-2], 147-151.
- 1731. Jones, S. (2004). Preventing baker's asthma. Occup Med (Lond). 54[5], 360.
- 1786. Adhikari, A., Reponen, T., Lee, S. A., and Grinshpun, S. A. (2004). Assessment of human exposure to airborne fungi in agricultural confinements: personal inhalable sampling versus stationary sampling. Ann Agric Environ Med. 11[2], 269-277.
- 1822. Burge, H. A., Solomon, W. R., and Muilenberg, M. L. (1982). Evaluation of indoor plantings as allergen exposure sources. J Allergy Clin Immunol. 70[2], 101-108.
- 1826. Wells, J. M. and Payne, J. A. (1976). Toxigenic species of Penicillium, Fusarium, and Aspergillus from weevil-damaged pecans. Can J Microbiol. 22[2], 281-285.
- 1855. Solomon, G. M., Hjelmroos-Koski, M., Rotkin-Ellman, M., and Hammond, S. K. (2006). Airborne mold and endotoxin concentrations in New Orleans, Louisiana, after flooding, October through November 2005. Environ Health Perspect. 114[9], 1381-1386.
- 1951. Xu, L. Y., Bandow, G. D., and Heffernan, M. P. (2007). Crusted violaceous plaques on an immunocompromised host. Arch Dermatol. 143[3], 417-422.
- 2001. Orman, A., Ficici, S. E., Ay, A., Ellidokuz, H., Sivaci, R. G., and Konuk, M. (2005). Detection of fungi spectrum in industrial and home bakeries and determinated fungal allergy with skin prick test. Asian Pac J Allergy Immunol. 23[2-3], 79-85.
- 2014. Dotterud, L. K., Vorland, L. H., and Falk, E. S. (1995). Viable fungi in indoor air in homes and schools in the Sor-Varanger community during winter. Pediatr Allergy Immunol. 6[4], 181-186.
- 2023. Bergmann, V. I., Rebohle, E., Wallenstein, G., Gemeinhardt, H., and Thrumer, H. (1976). [Frequency and importance of mold sensitization in bakery workers]. Allerg.Immunol.(Leipz.). 22[3], 297-301.
- 2069. Spurgeon, J. C. (2003). A method for detecting fungal contaminants in wall cavities. AIHA.J (Fairfax., Va.). 64[1], 40-47.
- 2076. Claeson, A. S., Sandstrom, M., and Sunesson, A. L. (2007). Volatile organic compounds (VOCs) emitted from materials collected from buildings affected by microorganisms. J Environ Monit. 9[3], 240-245.
- 2080. Krajewska-Kulak, E., Lukaszuk, C., Tsokantaridis, Ch, Hatzopoulu, A., Theodosopoyloy, E., Hatzmanasi, D., and Kosmois, D. (2007). Indoor air studies of fungi contamination at the Neonatal Department and Intensive Care Unit an Palliative Care in Kavala Hospital in Greece. Adv Med Sci. 52 Suppl 1:11-4., 11-14.
- 2239. Shen, H. D., Lin, W. L., Chen, R. J., and Han, S. H. (1990). Cross-reactivity among antigens of different air-borne fungi detected by ELISA using five monoclonal antibodies against Penicillium notatum. Zhonghua Yi.Xue.Za Zhi.(Taipei). 46[4], 195-201.
- 2280. Nissen, D., Nolte, H., Permin, H., Heinig, J., Skov, P. S., and Norn, S. (1999). Evaluation of IgE-sensitization to fungi in HIV-positive patients with eczematous skin reactions. Ann Allergy Asthma Immunol. 83[2], 153-159.
- 2342. Burge, H. A. (1985). Fungus allergens. Clin Rev Allergy. 3[3], 319-329.
- 2392. Pieckova, E. and Kunova, Z. (2002). Indoor fungi and their ciliostatic metabolites. Ann Agric Environ Med. 9[1], 59-63.
- 2401. Adhikari, A., Sen, M. M., Gupta-Bhattacharya, S., and Chanda, S. (2000). Incidence of allergenically significant fungal aerosol in a rural bakery of West Bengal, India. Mycopathologia. 149[1], 35-45.
- 2409. Chakrabarti, A., Nayak, N., Kumar, P. S., Talwar, P., Chari, P. S., and Panigrahi, D. (1992). Surveillance of nosocomial fungal infections in a burn care unit. Infection. 20[3], 132-135.
- 2416. Dobrowolski, J. W. and Smyk, B. (1993). Environmental risk factors of cancer and their primary prevention. J Environ Pathol Toxicol.Oncol. 12[1], 55-57.
- 2500. Kotimaa, M. H., Terho, E. O., and Husman, K. (1987). Airborne moulds and actinomycetes in work environment of farmers. Eur J Respir Dis Suppl. 152:91-100., 91-100.
- 2539. Chulze, S. N., Magnoli, C. E., and Dalcero, A. M. (2006). Occurrence of ochratoxin A in wine and ochratoxigenic mycoflora in grapes and dried vine fruits in South America. Int J Food Microbiol. 111 Suppl 1:S5-9. Epub;%2006 May 22., S5-S9.
- 2607. Lugauskas, A., Repeckiene, J., and Novosinskas, H. (2005). Micromycetes, producers of toxins, detected on stored vegetables. Ann Agric Environ Med. 12[2], 253-260.
- 2649. Cooley, J. D., Wong, W. C., Jumper, C. A., and Straus, D. C. (1998). Correlation between the prevalence of certain fungi and sick building syndrome. Occup Environ Med. 55[9], 579-584.
- 2654. Gora, A., Skorska, C., Sitkowska, J., Prazmo, Z., Krysinska-Traczyk, E., Urbanowicz, B., and Dutkiewicz, J. (2004). Exposure of hop growers to bioaerosols. Ann Agric Environ Med. 11[1], 129-138.
- 2669. Osborne, M., Reponen, T., Adhikari, A., Cho, S. H., Grinshpun, S. A., Levin, L., Bernstein, D. I., and LeMasters, G. (2006). Specific fungal exposures, allergic sensitization, and rhinitis in infants. Pediatr Allergy Immunol. 17[6], 450-457.
- 2694. BPC Inspection. (2008). Glossary : common bacteria and molds found in houses and buildings. Site de BPC Inspection . 4-28-2008.
- 2747. Dharmage, S., Bailey, M., Raven, J., Mitakakis, T., Thien, F., Forbes, A., Guest, D., Abramson, M., and Walters, E. H. (1999). Prevalence and residential determinants of fungi within homes in Melbourne, Australia. Clin Exp Allergy. 29[11], 1481-1489.
- 2750. Garrett, M. H., Rayment, P. R., Hooper, M. A., Abramson, M. J., and Hooper, B. M. (1998). Indoor airborne fungal spores, house dampness and associations with environmental factors and respiratory health in children. Clin Exp Allergy. 28[4], 459-467.
- 2758. Kurup, V. P., Shen, H. D., and Vijay, H. (2002). Immunobiology of fungal allergens. Int Arch Allergy Immunol. 129[3], 181-188.
- 2759. Lee, T., Grinshpun, S. A., Martuzevicius, D., Adhikari, A., Crawford, C. M., and Reponen, T. (2006). Culturability and concentration of indoor and outdoor airborne fungi in six single-family homes. Atmos.Environ. 40[16], 2902-2910.
- 2765. Monso, E. (2004). Occupational asthma in greenhouse workers. Curr Opin Pulm.Med. 10[2], 147-150.
- 2774. Zielinska-Jankiewicz, K., Kozajda, A., Piotrowska, M., and Szadkowska-Stanczyk, I. (2008). Microbiological contamination with moulds in work environment in libraries and archive storage facilities. Ann Agric Environ Med. 15[1], 71-78.
- 2809. Fischer, G., Schwalbe, R., Moller, M., Ostrowski, R., and Dott, W. (1999). Species-specific production of microbial volatile organic compounds (MVOC) by airborne fungi from a compost facility. Chemosphere. 39[5], 795-810.
- 2826. Lugauskas, A., Raudoniene, V., and Sveistyte, L. (2005). Toxin producing micromycetes on imported products of plant origin. Ann Agric Environ Med. 12[1], 109-118.
- 2841. Rautiala, S. H., Nevalainen, A. I., and Kalliokoski, P. J. (2002). Firefighting efforts may lead to massive fungal growth and exposure within one week. A case report. Int J Occup Med Environ Health. 15[3], 303-308.
- 2968. Fiedler, K., Schutz, E., and Geh, S. (2001). Detection of microbial volatile organic compounds (MVOCs) produced by moulds on various materials. Int J Hyg Environ Health. 204[2-3], 111-121.
- 2991. Pieckova, E. and Jesenska, Z. (1999). Microscopic fungi in dwellings and their health implications in humans. Ann Agric Environ Med. 6[1], 1-11.
- 3003. Abdel Hameed, A. A., Khoder, M. I., and Farag, S. A. (2000). Organic dust and gaseous contaminants at wood working shops. J Environ Monit. 2[1], 73-76.
- 3004. Ahearn, D. G., Crow, S. A., Simmons, R. B., Price, D. L., Mishra, S. K., and Pierson, D. L. (1997). Fungal colonization of air filters and insulation in a multi-story office building: production of volatile organics. Curr Microbiol. 35[5], 305-308.
- 3005. Ahearn, D. G., Crow, S. A., Simmons, R. B., Price, D. L., Noble, J. A., Mishra, S. K., and Pierson, D. L. (1996). Fungal colonization of fiberglass insulation in the air distribution system of a multi-story office building: VOC production and possible relationship to a sick building syndrome. J Ind Microbiol. 16[5], 280-285.
- 3008. Amezqueta, S., Gonzalez-Penas, E., Lizarraga, T., Murillo-Arbizu, M., and Lopez de, Cerain A. (2008). A simple chemical method reduces ochratoxin A in contaminated cocoa shells. J Food Prot. 71[7], 1422-1426.
- 3009. Araujo, R., Cabral, J. P., and Rodrigues, A. G. (2008). Air filtration systems and restrictive access conditions improve indoor air quality in clinical units: Penicillium as a general indicator of hospital indoor fungal levels. Am J Infect Control. 36[2], 129-134.
- 3010. Baur, X., Behr, J., Dewair, M., Ehret, W., Fruhmann, G., Vogelmeier, C., Weiss, W., and Zinkernagel, V. (1988). Humidifier lung and humidifier fever. Lung. 166[2], 113-124.
- 3011. Beaumont, F., Kauffman, H. F., Sluiter, H. J., and De, Vries K. (1985). Sequential sampling of fungal air spores inside and outside the homes of mould-sensitive, asthmatic patients: a search for a relationship to obstructive reactions. Ann Allergy. 55[5], 740-746.
- 3012. Beaumont, F., Kauffman, H. F., van der Mark, T. H., Sluiter, H. J., and De, Vries K. (1985). Volumetric aerobiological survey of conidial fungi in the North-East Netherlands. I. Seasonal patterns and the influence of metereological variables. Allergy. 40[3], 173-180.
- 3014. Bernstein, R. S., Sorenson, W. G., Garabrant, D., Reaux, C., and Treitman, R. D. (1983). Exposures to respirable, airborne Penicillium from a contaminated ventilation system: clinical, environmental and epidemiological aspects. Am Ind Hyg Assoc J. 44[3], 161-169.
- 3015. Bornehag, C. G., Sundell, J., and Sigsgaard, T. (2004). Dampness in buildings and health (DBH): Report from an ongoing epidemiological investigation on the association between indoor environmental factors and health effects among children in Sweden. Indoor Air. 14 Suppl 7:59-66., 59-66.
- 3021. Dassonville, C., Demattei, C., Detaint, B., Barral, S., Bex-Capelle, V., and Momas, I. (2008). Assessment and predictors determination of indoor airborne fungal concentrations in Paris newborn babies' homes. Environ Res. 108[1], 80-85.
- 3022. Dill, I. and Niggemann, B. (1996). Domestic fungal viable propagules and sensitization in children with IgE mediated allergic diseases. Pediatr Allergy Immunol. 7[3], 151-155.
- 3024. Duchaine, C. and Meriaux, A. (2000). Airborne microfungi from eastern Canadian sawmills. Can J Microbiol. 46[7], 612-617.
- 3026. Dutkiewicz, J., Skorska, C., Krysinska-Traczyk, E., Cholewa, G., Sitkowska, J., Milanowski, J., and Gora, A. (2002). Precipitin response of potato processing workers to work-related microbial allergens. Ann Agric Environ Med. 9[2], 237-242.
- 3029. Gent, J. F., Ren, P., Belanger, K., Triche, E., Bracken, M. B., Holford, T. R., and Leaderer, B. P. (2002). Levels of household mold associated with respiratory symptoms in the first year of life in a cohort at risk for asthma. Environ Health Perspect. 110[12], A781-A786.
- 3031. Goh, J. C., Juliana, J., Malina, O., Ngah, Z. U., and Norhafizalena, O. (2007). Prevalence of Penicillium specific Ig E level and allergy symptoms among office workers in a selected company in Bangi, Malaysia. Trop Biomed. 24[1], 37-46.
- 3034. Guglielminetti, M., Valoti, E., Cassini, P., Taino, G., and Caretta, G. (2001). Respiratory syndrome very similar to extrinsic allergic alveolitis due to Penicillium verrucosum in workers in a cheese factory. Mycopathologia. 149[3], 123-129.
- 3035. Heath, T. C., Patel, A., Fisher, D., Bowden, F. J., and Currie, B. (1995). Disseminated Penicillium marneffei: presenting illness of advanced HIV infection; a clinicopathological review, illustrated by a case report. Pathology. 27[1], 101-105.
- 3036. Heida, H., Bartman, F., and van der Zee, S. C. (1995). Occupational exposure and indoor air quality monitoring in a composting facility. Am Ind Hyg Assoc J. 56[1], 39-43.
- 3044. Kenny, L. C., Stancliffe, J. D., Crook, B., Stagg, S., Griffiths, W. D., Stewart, I. W., and Futter, S. J. (1998). The adaptation of existing personal inhalable aerosol samplers for bioaerosol sampling. Am Ind Hyg Assoc J. 59[12], 831-841.
- 3048. Kure, C. F., Skaar, I., Holst-Jensen, A., and Abeln, E. C. (2003). The use of AFLP to relate cheese-contaminating Penicillium strains to specific points in the production plants. Int J Food Microbiol. 83[2], 195-204.
- 3054. Marchisio, V. F., Sulotto, F., Botta, G. C., Chiesa, A., Airaudi, D., and Anastasi, A. (1999). Aerobiological analysis in a salami factory: a possible case of extrinsic allergic alveolitis by Penicillium camembertii. Med Mycol. 37[4], 285-289.
- 3055. McLellan, E. and Fenton, P. (2007). The problem with Penicillium. J Hosp Infect. 66[1], 87-88.
- 3066. Rautiala, S., Reponen, T., Hyvarinen, A., Nevalainen, A., Husman, T., Vehvilainen, A., and Kalliokoski, P. (1996). Exposure to airborne microbes during the repair of moldy buildings. Am Ind Hyg Assoc J. 57[3], 279-284.
- 3067. Reyes-Velazquez, W. P., Isaias, Espinoza, V, Rojo, F., Jimenez-Plasencia, C., de Lucas, Palacios E., Hernandez-Gobora, J., and Ramirez-Alvarez, A. (2008). Occurrence of fungi and mycotoxins in corn silage, Jalisco State, Mexico. Rev Iberoam.Micol. 25[3], 182-185.
- 3075. Sekhon, A. S., Stein, L., Garg, A. K., Black, W. A., Glezos, J. D., and Wong, C. (1994). Pulmonary penicillosis marneffei: report of the first imported case in Canada. Mycopathologia. 128[1], 3-7.
- 3078. Shen, H. D., Tam, M. F., Chou, H., and Han, S. H. (1999). The importance of serine proteinases as aeroallergens associated with asthma. Int Arch Allergy Immunol. 119[4], 259-264.
- 3079. Solomon, W. R. (1976). A volumetric study of winter fungus prevalence in the air of midwestern homes. J Allergy Clin Immunol. 57[1], 46-55.
- 3080. Solomon, W. R. (1975). Assessing fungus prevalence in domestic interiors. J Allergy Clin Immunol. 56[3], 235-242.
- 3081. Spurgeon, J. C. (2003). A sampling method for comparing fungal concentrations in carpets. AIHA.J (Fairfax., Va.). 64[6], 842-845.
- 3087. Van, Lancker F., Adams, A., Delmulle, B., De, Saeger S., Moretti, A., Van, Peteghem C., and De, Kimpe N. (2008). Use of headspace SPME-GC-MS for the analysis of the volatiles produced by indoor molds grown on different substrates. J Environ Monit. 10[10], 1127-1133.
- 3090. Watanabe, M. (2008). Production of mycotoxins by Penicillium expansum inoculated into apples. J Food Prot. 71[8], 1714-1719.
- 3092. Wouters, I. M., Spaan, S., Douwes, J., Doekes, G., and Heederik, D. (2006). Overview of personal occupational exposure levels to inhalable dust, endotoxin, beta(1-->3)-glucan and fungal extracellular polysaccharides in the waste management chain. Ann Occup Hyg. 50[1], 39-53.
- 3095. Foundation for Allergy Research in Europe. (1984). Atlas of moulds in Europe causing respiratory allergy. Knud Wilken-Jensen et Suzanne Gravesen. -110. Danemark, ASK Publising.
- 3102. Krska, R., Schubert-Ullrich, P., Molinelli, A., Sulyok, M., MacDonald, S., and Crews, C. (2008). Mycotoxin analysis: an update. Food Addit.Contam Part A Chem.Anal.Control Expo.Risk Assess. 25[2], 152-163.
- 3122. Zorman, T. (2008). Assessment of bioaeraosol concentration in different indoor environments. Indoor and Built Environment 17[2], 155-163.
- 3131. Randhawa, P. S., Nouraei, S. R., Howard, D. J., Sandhu, G. S., and Petrou, M. A. (2008). Penicillium species as a rare isolate in tracheal granulation tissue: a case series. J.Med.Case.Reports. 2:84., 84.
- 3133. Samson, R. A. and Pitt, J. I. (1992). Modern concepts in Penicillium and Aspergillus classification. Mycologia 84[6], 946-947.
- 3166. Licorish, K., Novey, H. S., Kozak, P., Fairshter, R. D., and Wilson, A. F. (1985). Role of Alternaria and Penicillium spores in the pathogenesis of asthma. J Allergy.Clin.Immunol. 76[6], 819-825.
- 3167. Merget, R., Sander, I., Rozynek, P., Heinze, E., Imoehl, M., Raulf-Heimsoth, M., and Bruening, T. (2008). Occupational immunoglobulin E-mediated asthma due to Penicillium camemberti in a dry-sausage packer. Respiration. 76[1], 109-111.
- 3176. Subramanian, C. V. (1983). Hyphomycetes : Taxonomy and Biology. Academic Press Inc. 342-355.
- 3179. Pieckova, E. and Kunova, Z. (2002). Indoor fungi and their ciliostatic metabolites. Ann.Agric.Environ.Med. 9[1], 59-63.
- 3180. Pieckova, E. (2003). In vitro toxicity of indoor Chaetomium Kunze ex Fr. Ann.Agric.Environ.Med. 10[1], 9-14.
- 3181. Jesenska, Z. and Bernat, D. (1994). Effect of mycotoxins on in vitro movement of tracheal cilia from one-day-old chicks. Folia.Microbiol.(Praha.). 39[2], 155-158.
- 3182. Bryden, W. L. (2007). Mycotoxins in the food chain: human health implications. Asia.Pac.J Clin.Nutr. 16 Suppl 1:95-101., 95-101.
- 3184. Heberer, T., Lahrssen-Wiederholt, M., Schafft, H., Abraham, K., Pzyrembel, H., Henning, K. J., Schauzu, M., Braeunig, J., Goetz, M., Niemann, L., Gundert-Remy, U., Luch, A., Appel, B., Banasiak, U., Bol, G. F., Lampen, A., Wittkowski, R., and Hensel, A. (2007). Zero tolerances in food and animal feed -- are there any scientific alternatives? A European point of view on an international controversy. Toxicol.Lett. 175[1-3], 118-135.
- 3185. Kendra, D. F. and Dyer, R. B. (2007). Opportunities for biotechnology and policy regarding mycotoxin issues in international trade. Int.J Food.Microbiol. %20;119[1-2], 147-151.
- 3189. van Egmond, H. P., Schothorst, R. C., and Jonker, M. A. (2007). Regulations relating to mycotoxins in food: perspectives in a global and European context. Anal.Bioanal.Chem. 389[1], 147-157.
- 3190. van Egmond, H. P. (2002). Worldwide regulations for mycotoxins. Adv.Exp.Med Biol. 504:257-69., 257-269.
- 3191. van Egmond, H. P. (1993). Rationale for regulatory programmes for mycotoxins in human foods and animal feeds. Food.Addit.Contam. 10[1], 29-36.
- 3193. Cooper, C. R. and Vanittanakom, N. (2008). Insights into the pathogenicity of Penicillium marneffei. Future.Microbiol. 3[1], 43-55.
- 3194. Cao, C., Li, R., Wan, Z., Liu, W., Wang, X., Qiao, J., Wang, D., Bulmer, G., and Calderone, R. (2007). The effects of temperature, pH, and salinity on the growth and dimorphism of Penicillium marneffei. Med Mycol. 45[5], 401-407.
- 3195. Vanittanakom, N., Cooper, C. R., Jr., Fisher, M. C., and Sirisanthana, T. (2006). Penicillium marneffei infection and recent advances in the epidemiology and molecular biology aspects. Clin.Microbiol.Rev. 19[1], 95-110.
- 3197. McCallum, J. L., Tsao, R., and Zhou, T. (2002). Factors affecting patulin Production by Penicillium expansum. Journal of Food Protection 65[12], 1937-1942.
- 3198. Barkai-Golan R. and Paster, N. (2008). Mycotoxins in fruits and vegetables. -408. Academic Press.
- 3209. Nissen, D., Petersen, L. J., Esch, R., Svejgaard, E., Skov, P. S., Poulsen, L. K., and Nolte, H. (1998). IgE-sensitization to cellular and culture filtrates of fungal extracts in patients with atopic dermatitis. Ann.Allergy.Asthma.Immunol. 81[3], 247-255.
- 3211. Rouzaud, P., Soulat, J. M., Trela, C., Fraysse, P., Recco, P., Carles, P., and Lauque, D. (2001). Symptoms and serum precipitins in workers exposed to dry sausage mould: consequences of exposure to sausage mould. Int.Arch.Occup.Environ.Health. 74[5], 371-374.
- 3215. Rippon, J. W. (1988). Medical mycology: the pathogenic fungi and the pathogenic actinomycetes. 2e. Philadelphie, WB Saunders Co.
- 3216. Liebler, G. A., Magovern, G. J., Sadighi, P., Park S.B., and Cushing W.J. (1977). Penicillium granuloma of the lung presenting as solitary pulmonary nodule. JAMA 237, 671.
- 3219. Smyth, G. O. L. (1964). Fungal infection in otology. Br J Dermatol 76, 425-428.
- 3220. Huang, S. N. and Harris, L. S. (1963). Acute disseminated penicillosis. Am J Clin Pathol 39, 167-174.
- 3239. Campbell, J. A., Kryda, M. J., Treuhaft, M. W., Marx, J. J., Jr., and Roberts, R. C. (1983). Cheese worker's hypersensitivity pneumonitis. Am.Rev.Respir.Dis. 127[4], 495-496.
- 3242. Lyratzopoulos, G., Ellis, M., Nerringer, R., and Denning, D. W. (2002). Invasive infection due to penicillium species other than P. marneffei. J Infect. 45[3], 184-195.